Зміст
Каннабіс (Cannabis sativa, або конопля) і його складові, зокрема каннабіноїди, були в центрі великих хімічних і біологічних досліджень протягом майже півстоліття з моменту відкриття хімічної структури його основного активного компонента, Δ9—тетрагідроканнабінолу (Δ9—ТГК). Поведінкові і психотропні ефекти рослини пояснюються вмістом в ньому сполук цього класу, канабіноїдів, в першу чергу Δ9-ТГК, який виробляється в основному в листі і квіткових бутонах рослини. Крім Δ9-ТГК, існують також непсихоактивні каннабіноїди з декількома лікарськими функціями, такими як каннабідіол (CBD), каннабіхромен (CBC) і каннабігерол (CBG), поряд з іншими неканнабіноїдними компонентами, що належать до різних класів натуральних продуктів. На сьогоднішній день в канабісі виявлено понад 560 складових. Недавні відкриття лікарських властивостей каннабісу та каннабіноїдів на додаток до їх потенційного застосування в лікуванні ряду серйозних захворювань, таких як глаукома, депресія, невралгія, розсіяний склероз, хвороба Альцгеймера та полегшення симптомів ВІЛ/СНІДу та раку, дали імпульс пошукам подальшого розуміння хімії, біології та лікарських властивостей цієї рослини.
У цьому матеріалі представлений огляд ботаніки, аспектів вирощування та фітохімії канабісу та його хімічних компонентів. Особлива увага приділяється нещодавно ідентифікованим / ізольованим з’єднанням. Крім того, також розглядаються методи виділення компонентів каннабісу та аналітичні методи, що використовуються для якісного та кількісного аналізу каннабісу та його продуктів.
Введення
Cannabis sativa L. (Cannabaceae) зустрічається в різних місцях проживання і на висотах, починаючи від рівня моря і закінчуючи альпійськими передгір’ями Гімалаїв, звідки він, можливо, стався [1]. Вирощування та використання канабісу від 5000 до 6000 років, що ускладнює точне визначення походження цього виду [2]. Крім того, це один з найстаріших рослинних джерел харчових і текстильних волокон [3]. Вирощування C. sativa бо текстильне волокно походить з Єгипту і Західної Азії і згодом було завезено в Європу між 1000 і 2000 роками до н.е. і в Південну Америку (Чилі) в 1545 році. Понад 60 років тому (1606) культивування конопель було введено в Північній Америці (Порт-Ройял, Канада) [4]. Діючі федеральні закони в Сполучених Штатах забороняють вирощування C. sativa, в тому числі конопель.
Канабіс сатіва має багату історію лікарського застосування, що йде корінням в стародавні часи. Перші відомості про його медичне застосування прийшли з Близького Сходу і Азії в шостому столітті до н. е. Його впровадження в західну медицину сталося набагато пізніше, на початку дев’ятнадцятого століття [56]. Цей вид був показаний при лікуванні болю, глаукоми, нудоти, депресії і невралгії [7, 8, 9, 10, 11]. Терапевтична цінність фитоканнабиноидов також використовувалася для лікування симптомів ВІЛ/Сніду та лікування розсіяного склерозу [12, 13].
Номенклатура
Ботанічна номенклатура
таксономічна Класифікація сатіви канабісу наведена нижче:
Царство:Plantae (рослини)
Підпорядкованість: Трахеобіонти (Судинні рослини)
Супердивизион: Сперматофиты (насіннєві рослини)
Поділ:Магноліофіту (квітучі рослини)
Клас:Магноліопсида (дводольні)
Підклас:Hamamelididae
Замовлення:
Сім’я: Канабісні
Рід: Конопля
Вид: сатіва
Абревіатура таксономічного органу: L.
Кількість видів у роді канабіс було предметом довгих дебатів. Систематики по-різному охарактеризували рід “канабіс”, ґрунтуючись на його політиповій природі [14, 1516]. Шульц та ін розділили цей рід на три окремих види: Cannabis sativa, Cannabis indicaі Cannabis ruderalis[17]. На відміну від цього, кілька інших дослідників вважали, що рід має два основних види: C. sativaі C. indica[1819]. Однак, незважаючи на ці різні таксономічні інтерпретації, Каннабіс зазвичай розглядається як представляє собою тільки один, дуже різноманітний вид, C. sativa L.[20, 21, 22, 23]. C. sativa, C. indicaі C. ruderalisв даний час визнані різновидами C. sativa L.(вар. сатіва, вар. індикаі вар. рудераліс, відповідно). Сорти сатіваіІндікає більш економічно важливими і широко поширеними, в той час як рудераліс вважається більш витривалим сортом, вирощуваним в північних Гімалаях і південних штатах колишнього Радянського Союзу, який характеризується рідкісним зростанням “бур’янів” і рідко культивується через вміст в ньому ліків. У порівнянні з сатівою, для якої середня висота рослин коливається від 2,5 до 3,5 м, рослини індикисорт, як правило, коротше (середня висота близько 1,8 м) і більш пишний, з більш широкими і темно-зеленим листям, які рано дозрівають при вирощуванні на відкритому повітрі.

Поширені назви
У всьому світі місцеве населення називає Каннабіс сатіва багатьма поширеними назвами, деякі з яких коротко викладені нижче.
Арабська:Аль-Бханго; Аль-Гашиш; Аль-Канаап
Китайський: Сіань ма; е ма
Данська:Конопля
Голландський:Хеннеп
Англійська:конопля; марихуана
Фінська:Hamppu
Французька:Chanvre; chanvre d Inde; chanvre indien; chanvrier; chanvrier
Німецька:Hanf; Haschisch; indischer Hanf
Індіанки:Бханг; чарас; гянджа
Японський:Машинін
Непальський:Cares; gajiimaa; gaanjaa
Португальська:Cânhamo; maconha
Російська:канабіс сатіва
Іспанська:Cáñamo; grifa; hachís; mariguana; marijuana
Шведська:Порканча
Конопля сатіва зазвичай є дводомним видом, тобто чоловічі і жіночі квітки розвиваються на окремих рослинах. Стать визначається за гетероморфними хромосомами, причому самці гетерогаметичні (XY), а самки гомогаметичні (XX). Морфологічно важко ідентифікувати чоловічі та жіночі рослини на вегетативній стадії. При статевому диморфізмі, що виникає на пізніх стадіях розвитку рослин, чоловічі рослини можна відрізнити від жіночих рослин після початку цвітіння. Молекулярні методи можуть бути використані для диференціації чоловічих і жіночих рослин на ранній стадії [24, 25, 26, 27, 28, 29]. Статевий фенотип канабісу іноді проявляє гнучкість, що приводить до утворення гермафродитных двостатевих квіток або суцвіть, тобто грошового фенотипу.
Визначення канабісу
Згідно з Кодексом Сполучених Штатів (USC), термін “марихуана/Каннабіс” визначається як “всі частини рослини C. sativaL., незалежно від того, ростуть вони чи ні; їх насіння; смола, витягнута з будь-якої частини рослини; і кожне з’єднання, процес виробництва, сіль, похідні, суміш або препарати рослини, його насіння або смола. Таке визначення не включає зрілих стебел, волокна, вироблені з стебел, масло або харчові страви, приготовані з насіння, будь-яке інше з’єднання, солі,похідні і суміші, стебла (крім смол, виділених з них), волокна, масла, Макуха, або стерилізовані насіння, які не здатні до проростання” [30].
“Канабіс” – це лікарський препарат, що готується з дводольного (рослини з проростають листям), трав’янистого (без деревні, надземні частини яких відмирають після плодоношення), дводомного (чоловічі особини відрізняються від жіночих), апетитального (квітка має віночок), однорічної трав’янистої рослини, с.Sativa l. і його різновидів (сімейство: Cannabaceae), які біосинтезують терпенофенольні канабіноїди або фітоканабіноїди, що накопичуються переважно в залізистих трихомах рослини.
Вирощування канабісу сатіва
Канабіс сатіва– це однорічна культура, яку можна успішно вирощувати як в приміщенні, так і на відкритому повітрі, причому кожна з них має свої переваги і недоліки. У той час як при вирощуванні в приміщенні можна регулювати фотоперіод, щоб викликати цвітіння і дозрівання (можливо три-чотири врожаю в рік), вирощування в умовах відкритого грунту зазвичай обмежується одним урожаєм в рік (потрібно від п’яти до семи місяців в залежності від сорту).
Вирощування на відкритому повітрі
Вирощування нового врожаю з насіння зазвичай починається в кінці березня-початку квітня. Збір врожаю зазвичай триває до листопада-початку грудня в Північній півкулі, але це залежить від сорту. Насіння висівають в невеликі біорозкладані горщики, а потім відібрані здорові саджанці пересаджують в поле. В якості альтернативи насіння можуть бути посаджені безпосередньо в поле. Чоловічі квітки, а потім жіночі квітки з’являються протягом двох-трьох місяців (середина липня) після посіву/пересадки. Як правило, відбраковують чоловічі рослини, так як чоловічі рослини містять менше Δ9-тетрагідроканнабінолу (Δ9-THC) в порівнянні з жіночими рослинами, і це також дозволяє уникнути перехресного запилення як серед різних сортів, так і всередині одного і того ж сорту.
Хоча рослини, вирощені на відкритому повітрі, мають більше біомаси в порівнянні з рослинами, вирощеними в приміщенні, в залежності від погоди і наданого простору, важко підтримувати постійний хімічний профіль в умовах вулиці, якщо вони вирощені з насіння, через аллогамной природи C. sativa (перехресне запліднення). Тому вегетативне розмноження живцями є підходящим методом для підтримки однорідності хімічних профілів вироблених культур.
Вирощування в приміщенні
Вирощування сатіви канабісу в приміщенні в контрольованих умовах навколишнього середовища дозволяє повністю контролювати життєвий цикл рослини, що призводить до управління якістю і кількістю біомаси. Це важливо при виробництві C. sativa з певним хімічним профілем для фармацевтичного застосування. Параметри навколишнього середовища, такі як рівень освітленості, фотоперіод, вологість, температура, концентрація CO2 і циркуляція повітря, відіграють вирішальну роль у виробництві цієї установки всередині приміщень.
Коноплі sativa вимагає високої щільності потоку фотосинтетичних фотонів (PPFD) для фотосинтезу і зростання [31]. Власні дослідження, проведені цими авторами, показали, що C. sativaможе використовувати досить високий рівень PPFD і температуру для процесів обміну газом та водяною парою і може працювати набагато краще, якщо вирощувати при температурі близько 1500 мкмоль м-2з-1PPFD (порівнянний з сонячним літнім днем в північній частині Міссісіпі) і температурою близько 25-30°C. Для розмноження в приміщенні можуть використовуватися різні джерела світла, а саме люмінесцентні лампи для молодих живців і металогалогенні (MH) і/або натрієві лампи високого тиску (HPS) для дорослих рослин. Для регулювання ламп MH і HPS потрібні окремі Баласти. Цибулини MH і HPS повинні знаходитися на відстані 0,9-1,2 м від рослин, щоб уникнути надмірного впливу. Однак при використанні цибулин для вирощування в приміщенні важко досягти рівнів фотосинтетично активного випромінювання (PAR) до 1500 мкмоль м-2з-1PPFD. Крім того, фотоперіоди відіграють важливу роль у регулюванні вегетативного та квітучого росту C. sativa.ці рослини підтримують стадію вегетативного росту за умови, що підтримується цикл фотоперіоду, що складається з >18 год світла і ≤6 год темряви. 12-годинний фотоперіод викликає цвітіння C. sativa [31].
У приміщенні для вирощування рівень вологості має вирішальне значення для всіх стадій росту рослин, починаючи від проростання насіння або вегетативного розмноження до розпускання бруньок і збору врожаю. Молоді рослини вимагають високої вологості в порівнянні з добре розвиненими рослинами. Вегетативні живці вимагають регулярного розпилення води на листя для підтримки високої вологості (близько 70-75%) в своєму мікрокліматі до тих пір, поки рослини не укореняться, в той час як активні стадії вегетації і цвітіння вимагають вологості 55-60%. Кількість і частота поливу для C. sativaзалежить від безлічі факторів, таких як стадія росту, розмір рослин і горщиків, температура, вологість та інші параметри. На ранній стадії розсади або вегетації рекомендується підтримувати грунт вологою; однак верхній шар грунту повинен бути сухим до поливу укорінених рослин.
Циркуляція повітря є ще одним важливим аспектом середовища вирощування в приміщенні. Регулювання газо – і парообміну між листям і мікрооточенням досягається за рахунок повітряного потоку навколо поверхонь листя. Це впливає на теплопровідність прикордонного шару листя, енергетичний бюджет і, в кінцевому рахунку, на фізіологію і зростання рослини.для управління циркуляцією повітря можна використовувати електричні вентилятори. Повідомляється, що подвоєння концентрації CO2 в навколишньому середовищі стимулює швидкість фотосинтезу і ефективність використання води (WUE) у C. sativa.на 50 і 111% відповідно, що призвело до збільшення загального зростання [31].
Розмноження насінням
Розмноження, починаючи з насіння, є найбільш популярним і традиційним методом вирощування C. sativa. Насіння цього виду потребують вологому середовищі, на додаток до тепла і циркуляції повітря для оптимального проростання. Для пророщування насіння може бути використано кілька методів. Найбільш популярним методом є посадка насіння в невеликі біорозкладані горщики, що містять вологий, аерований грунт. Теплові Килимки для розсади можна розмістити під горщиками, щоб підвищити температуру грунту і підвищити схожість протягом зими.
Проростання насіння починається через чотири-п’ять днів, причому більшість життєздатних насіння проростає протягом 15 днів, в залежності від сорту насіння, віку і умов зберігання, а також температури грунту і води. Розсаду слід піддати впливу холодного флуоресцентного світла (18-годинний фотоперіод) для початкового вегетативного росту, потім пересадити у великі горщики (30 × 30 см) і піддати впливу світла повного спектру (18-годинний фотоперіод) для бажаного вегетативного росту. Рослини можуть піддаватися впливу 12-годинного фотоперіоду, коли досягнуть відповідної вегетативної маси, яка викликає цвітіння приблизно через два тижні. Чоловічі квітки з’являються раніше жіночих, що дозволяє відокремлювати або відбраковувати чоловічі рослини, якщо потрібні бутони “сінсемілли”. Живці з гілок жіночих рослин можна використовувати для вегетативного розмноження. Якщо потрібен певний хімічний профіль, слід провести хімічний аналіз, щоб допомогти у виборі відповідного хемотипу або клону.
Розмноження живцями
Існує кілька способів вегетативного розмноження рослин C. sativa. Три основних типи-щеплення, повітряне нашарування і використання живців. Ці три типи називаються макророзмноженням, на відміну від мікророзмноження або культивування тканин. Розмноження живцями є найбільш зручним, ефективним і в цілому кращим методом для C. sativa. Як тільки клон з певним хімічним профілем буде перевірений і відібраний, свіжий Вузловий сегмент довжиною близько 6-10 см, що містить щонайменше два вузли від материнської рослини, може бути використаний для вегетативного / звичайного розмноження. Вегетативне розмноження C. sativa може бути ефективно здійснено з використанням або твердої (грунт), або рідкого середовища (гідропоніка).
Для розмноження в грунті верхівкову гілку зрізають під кутом 45° безпосередньо під вузлом і негайно занурюють в дистильовану воду. Підстава зрізу (2 см) потім занурюють в гормон вкорінення (Green Light, США) і висаджують в горщики (5х5 см), що містять натуральне живильне середовище coco і суміш (1:1) стерильної суміші для горщиків і Fertilome®(Канна Континенталь, США). Принаймні один вузол повинен бути покритий грунтом для ефективного вкорінення. Рослини регулярно зрошуються і містяться в контрольованих умовах навколишнього середовища. укорінення починається через два-три тижні, а потім через шість тижнів слід пересадка в великі горщики (наприклад, 30х30 см).
Для розмноження в гідропоніці живці поміщають на глибину 2,5 см3з кам’яної вати або в підтримуючу середу з гідротонного глиняного кулі. Рослини забезпечуються формулою рослинного добрива (Advance Nutrient, Канада) для вегетативного росту. Укорінення і пересадка аналогічні розмноженню в грунті. Для вегетативного росту рослини витримують в 18-годинному фотоперіоді до тих пір, поки вони не досягнуть бажаного розміру, а світловий цикл змінюється на 12-годинний фотоперіод для цвітіння і дозрівання.
Мікророзмноження
Метод культивування тканин є потужним інструментом, який може бути використаний в якості альтернативи традиційному методу вегетативного розмноження з метою підвищення швидкості розмноження бажаних генотипів. Крім того, культура рослинних тканин є важливою прикордонною областю в біотехнології рослин і не тільки сприяє масовому розмноженню, але і дає переваги з точки зору поліпшення врожаю і збереження зародкової плазми, зокрема, для вегетативно розмножуються культур. Хоча вегетативне розмноження є стандартним для C. sativa, воно обмежене повільною швидкістю розмноження, поганою виживаністю деяких клонів і необхідністю рясної початкової посадки. Тому методи розмноження in vitro пропонують потужні інструменти для масового розмноження і збереження зародкової плазми цього важливого виду лікарських рослин. Власні методології, створені авторами, призвели до оптимізованих простих і ефективних протоколів мікророзмноження C. sativaз використанням методів апікального вузлового сегмента (прямий органогенез) і эксплантации листя (непрямий органогенез) [32, 33].
У вищезгаданому внутрішньому протоколі прямого органогенезу апікальні вузлові сегменти, що містять нирки (довжиною близько 1 см), використовувалися в якості експланта для ініціації культур пагонів. Експланти були отримані з здорових гілок скринірованного і відібраного високоврожайного клону C. sativa, вирощеного в приміщенні для вирощування. Експланти піддавали поверхневій дезінфекції з використанням 0,5% NaOCl (15% в/в відбілювач) і 0,1% твіна 20 протягом 20 хв. Експланти тричі промивали в стерильній дистильованій воді протягом 5 хв перед посівом на живильне середовище. Мікророзмноження та загартовування мікророзмножених рослин проводили відповідно до протоколу, описаного Латою та ін. [36]. Найкраща відповідь на індукцію пагонів цього виду спостерігався при використанні середовища Мурасіге і Скуга (MS), що містить 0,5 мкм тідіазурон (TDZ). Добре розвинені пагони потім переносили в середовище MS половинної міцності з активованим вугіллям, доповненим різними концентраціями індол-3-оцтової кислоти (IAA), індол-3-масляної кислоти (IBA) і нафталінової оцтової кислоти (NAA) для вкорінення. Найвищий відсоток вкорінення в мікророзмножуваних рослинах був досягнутий в солях Мурасіге і Скуга половинної міцності (1/2 МС) з активованим вугіллям 500 мг/дм3, доданим 2,5 мкмМБА.
Для непрямого органогенезу каллус-опосередкована регенерація рослин є простим способом отримання сомаклональних варіантів, як було підкреслено для декількох рослин [34, 35]. Феномен сомаклональної мінливості допомогою непрямого органогенезу дає можливість розкрити природну мінливість рослин і використовувати цю генетичну мінливість для розробки нових продуктів та поліпшення врожаю [36]. На частоту сомаклональних змін впливають багато факторів, такі як види рослин, генотип і тип беруть участь експлантів, протокол культивування, застосовуваний в процесі in vitro, і, зокрема, гормональний склад середовища, а також кількість субкультур [37, 38]. В лабораторії справжніх авторів була розроблена система in vitro для отримання калюсної культури і регенерованих рослин каннабіса з тканини листя шляхом непрямого органогенезу високоврожайного сорту C. sativa [33]. Каллі були введені з експлантів листя на середовищі Мурасіге і Скуга, доповненої різними концентраціями (0,5, 1,0, 1,5 і 2,0 мкм) IAA, IBA, NAA і 2,4-дихлорфеноксиуксусной кислоти (2,4-D) в поєднанні з 1,0 мкмтидіазуроном (TDZ). Оптимальний ріст і підтримка каллуса забезпечувалися при використанні 0,5 мкмцих ауксинів поряд з 1,0 мкмTDZ. Каллі 2-місячного віку культивували в середовищі MS, що містить різні концентрації цитокінінів [6-бензоамінопурин (БАП), кінетин (Кн) і TDZ]. Швидкість індукції і проліферації пагонів була найвищою в 0, 5 мкм. Регенеровані пагони найкраще вкорінюються на середовищі MS з половинною міцністю, доповненої 2,5 мкмМБА різних використовуваних ауксинів (IAA, IBA і NAA).
Застосування мікророзмноження для великомасштабного виробництва елітних клонів є ефективною і чудовою альтернативою насінню і звичайним живцям. Незважаючи на свій потенціал, ця техніка не виправдала очікувань і як і раніше стикається з багатьма проблемами. Одним з його основних обмежень є погана виживання саджанців після переведення з умов in vitro в природну неконтрольовану середовище [39]. Ці проблеми обмежили застосування технології мікророзмноження для масового виробництва багатьох цінних видів лікарських рослин. Крім того, точність клонування з точки зору генетичної стабільності, стабільного хімічного профілю і порівнянного хімічного складу є однією з найбільш важливих передумов мікророзмноження видів рослин, що представляють фармацевтичний інтерес. Тому для комерційного використання вкрай важливо порівняти хімічний профіль, вміст корисних вторинних метаболітів і генетичну стабільність рослин, вирощених in vitro, з материнськими рослинами. У нашій лабораторії рослини C. sativa, вирощені на культурі тканин, порівнюються з материнськими рослинами і звичайними рослинами на предмет їх генетичної стабільності, профілів і вмісту каннабіноїдів.
Маркери на основі ДНК з повторенням простої послідовності (ISSR) успішно використовувалися в лабораторії авторів для моніторингу генетичної стабільності мікророзмножених рослин (з використанням апікальних вузлових сегментів) C. sativaдо 30 пасажів у культурі, які отверждаются в грунті протягом восьми місяців [32]. П’ятнадцять праймерів ISSR генерували в цілому 115 виразних і відтворюваних смуг. Малюнок смужок для кожного праймера був однорідним і порівнянним з малюнком материнської рослини, з якого були створені культури. Грунтуючись на отриманих результатах, протокол мікророзмноження стандартизований для C. sativaможна використовувати в комерційних цілях з мінімальною можливістю будь-якої мінливості, викликаної in vitro.
Для оцінки стабільності хімічного профілю в мікророзмножених рослин, газової хроматографії-полум’яно-іонізаційний виявлення (ГХ-під) був використаний для оцінки хімічних речовин і кількісне визначення канабіноїдів, щоб виявити відмінності, якщо такі є, в хімічний склад в лабораторних умовах розмножується вегетативно рослини проти вирощуваних рослин і материнською рослиною [32, 40]. У загальному випадку Δ9– ТГК вміст у всіх групах збільшувався з віком рослин до найвищого рівня на стадії бутонізації, коли вміст цієї сполуки досягав рівня до початку старіння. У всіх групах рослин картина змін, що спостерігаються в концентрації інших каннабіноїдів в залежності від віку рослин, слідувала аналогічної тенденції. Якісно, профілі канабіноїдів, отримані з використанням GC-FID в материнських рослинах, рослинах, вирощених вегетативно, і рослинах, розмножених in vitro, були знайдені схожими один на одного і на профілі вирощених в польових умовах материнських рослин C. sativa. Незначні відмінності, що спостерігаються в концентрації каннабіноїдів всередині і між групами, не були статистично значущими. Ці результати підтвердили клональну точність наших рослин C. sativa, розмножених in vitro,і припускають, що протоколи, використовувані в цих дослідженнях для отримання рослин, розмножуваних мікророзмноженням, не впливають на результуючий метаболічний профіль. Крім того, цей підхід може бути використаний для масового розмноження рослин цього виду, відповідних типам, для комерційного фармацевтичного використання.
Збір, переробка та зберігання біомаси сатіва канабісу
Визначення оптимальної стадії збору врожаю є критичним етапом у культивуванні C. sativa для забезпечення необхідного хімічного профілю, наприклад, оптимального вмісту Δ9-ТГК. Це може бути досягнуто шляхом щоденного аналізу вмісту каннабіноїдів у різних частинах рослини. Вміст ТГК збільшується з віком рослини до найвищого рівня на стадії бутонізації, після чого воно досягає плато приблизно протягом одного-двох тижнів, а потім знижується з початком старіння. Крім того, вміст ТГК зазвичай вище до полудня. Верхні Зрілі нирки можуть бути зібрані першими, даючи час для дозрівання нижніх незрілих нирок. Візуальною ознакою зрілості є колір рильців, які зморщуються і стають коричневими в міру дозрівання квітів.
Комерційний амбар для сушіння тютюну, такий як BulkTobac (Gas-Fired Products, Inc., США), може використовуватися для сушіння біомаси при великомасштабному вирощуванні (12-15 год, 40°C); лабораторна піч може використовуватися для невеликих зразків (ніч, 40°C). Опале листя і стебла слід видалити з зрілих нирок перед сушінням. Цілі бутони можна висушити, або бутони можна розрізати на більш дрібні шматочки. Висушений рослинний матеріал можна обробити вручну. Всі залишилися листя слід відокремити від нирок. Нирки ретельно пропускають через сита різного розміру, щоб відокремити дрібні стебла і насіння. Автоматизовані машини для обробки рослин також можуть використовуватися для відділення великих стебел і насіння від корисної біомаси.
Належним чином висушену і оброблену біомасу каннабісу можна зберігати в поліетиленових пакетах, схвалених FDA, поміщених в герметичні волокнисті барабани (короткочасна температура: 18-20°C; Довгострокова температура: -10°C). Основною проблемою при зберіганні C. sativaє стабільність багатьох канабіноїдів. Деградація ТГК незначна під час обробки, особливо коли матеріал добре висушений і запечатаний; однак він як і раніше надзвичайно чутливий до кисню і ультрафіолетового випромінювання, і повільна деградація відбувається при зберіганні при кімнатній температурі шляхом окислення до каннабідіолу (CBD). Крім того, легко перетворюється в (−)-Δ8–транс-тетрагідроканнабінол (Δ8-ТГК) під термодинамічним контролем. Тому переважними Умовами для тривалого зберігання є низька температура і відсутність світла.
Хемотаксис * канабісу
Канабіс сатіва– хімічно складний вид, це висновок заснований на наявності численних підтверджених природних компонентах і вторинних метаболітів. Концентрація Δ9-ТГК у висушеному суцвітті (листі і бутонах) використовується для визначення його психоактивності. Кількісний і якісний аналіз канабісу може бути використаний для характеристики його фенотипу і фитоканнабиноидного профілю [25].
Коноплі можна розділити на три фенотипи: фенотип I (наркотичний тип), з Δ9-ТГК (>0,5%, а каннабидиол (CBD) <0.5% (Δ9-ТГК/CBD ≫ 1)); проміжний фенотип II (проміжного типу), з CBD в якості основних каннабіноїдів, але при цьому Δ9-ТГК також є в різних концентраціях (Δ9-ТГК/CBD ~ 1); і фенотип III (в волокна типу чи конопель), з особливо низьким Δ9-ТГК, зміст (Δ9-ТГК/CBD ≪ 1). Коноплі зазвичай містить непсихоактивные каннабіноїди в якості основних компонентів, наприклад, CBD або каннабигерол (CBG) [41, 42]. Хоча фактори навколишнього середовища відіграють роль у визначенні кількості каннабіноїдів, присутніх в різних частинах рослини на різних стадіях росту [43], співвідношення CBD:Δ9-THC, очевидні в більшості популяцій, знаходяться під генетичним контролем [44].
Біосинтез фітоканабіноїдів
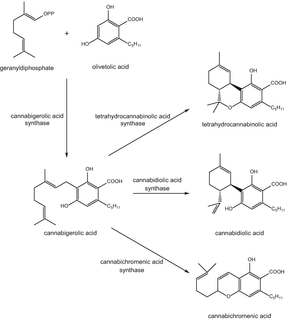
Фітоканабіноїди являють собою терпенофенольні сполуки, хімічно пов’язані з терпенами, з їх кільцевою структурою, отриманою з геранілпірофосфату (монотерпенова субодиниця c 10). Цитозольний мевалонат і пластидіальний метилеритритфосфат (MEP) є двома незалежними шляхами, які, як повідомляється, відповідають за біосинтез терпеноїдів рослин. Повідомляється, що пластидиальный метилэритрит фосфат відповідає за біосинтез каннабиноидной терпеноидной частини [45]. Перший крок у шляху біосинтезу канабіноїдів (схема 1) є утворенням оливкової кислоти, шлях біосинтезу якої до кінця не з’ясований. Однак було висловлено припущення, що в цьому може бути задіяна полікетидсинтаза III типу, оливетолсинтаза [46]. Оливкова кислота та геранілдіфосфат з’єднуються під впливом пренілази, геранілдіфосфат:геранілтрансфераза оливкової олії, що утворює каннабігеролову кислоту (CBGA). Це, в свою чергу, окислюється циклічними Флавін-аденіндинуклеотидзавісімимі (fad) оксидазами, а саме Δ9-тетрагідроканнабінолової кислотою (Δ9-THCA) синтаза, синтаза каннабідіолової кислоти (CBDA) і синтаза каннабіхроменової кислоти (CBCA), що продукує Δ9-тетрагідроканнабінолову кислоту, каннабидиоловую кислоту і каннабихроменовую кислоту [47, 48].
Склад канабісу сатіва
Загальна кількість природних сполук, ідентифікованих або виділених з C. sativa, продовжувала збільшуватися протягом останніх кількох десятиліть. У 1980 році Тернером та ін. повідомлялося про 423 сполуки цієї рослини [49], і це число збільшилося в 1995 році до 483 [50]. В період з 1995 по 2005 рік було додано сім сполук [51]. Основна увага в цьому розділі приділяється хімічному опису нещодавно зареєстрованих 49 каннабіноїдів, а також 26 неканнабіноїдних компонентів (таблиця 1), в цілому 565 сполук, ідентифікованих на сьогоднішній день.
Каннабіноїди
Натуральні продукти, виділені з C.sativa, що мають типовий терпенофенольний скелет c21, називаються “канабіноїдами”. Цей клас сполук має похідні та продукти трансформації, які також вважаються каннабіноїдами. З моменту початку хімічних досліджень C. sativaна сьогоднішній день було виділено в загальній складності 120 каннабіноїдів (Таблиця 1), які можна розділити на 11 загальних типів: (−)-Δ9–транс-тетрагідроканнабінол (Δ9-ТГК), (−)-Δ8–транс-тетрагідроканнабінол (Δ8-THC), каннабигерол (CBG), каннабихромен (CBC), каннабидиол (CBD), каннабинодиол (CBND), каннабиелсоин (CBE), каннабициклол (CBL), каннабинол (CBN), каннабитриол (CBT) і інші типи.
Таблиця 1
компоненти C. sativa L. за хімічним класом
|
хімічний клас |
2005 |
2015 |
|---|---|---|
|
Δ9– Тип ТГК |
9 |
23 |
|
Δ 8– Тип ТГК |
2 |
5 |
|
тип CBG |
8 |
16 |
|
тип CBC |
6 |
9 |
|
тип |
7 |
7 |
|
тип CBND |
2 |
2 |
|
тип CBE |
5 |
5 |
|
тип CBL |
3 |
3 |
|
тип CBN |
7 |
11 |
|
тип ТОС |
9 |
9 |
|
різні типи |
14 |
30 |
|
Загальна кількість каннабіноїдів |
72 |
120 |
|
всього неканабіноїдів |
419 |
445 |
|
всього |
491 |
565 |
( – ) – Δ9– транс-тетрагідроканнабінол (Δ9-ТГК) типу
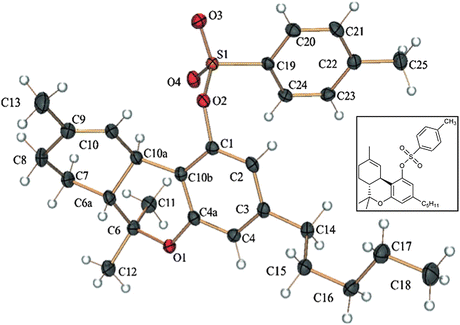
Гаоні і Мехулам вперше повідомили про структуру Δ9-THC (1) і визначили його абсолютну конфігурацію як транс-(6aR,10AR) [52]. Нещодавно рентгенокристалічний аналіз тозилатного ефіру 1підтвердив його раніше задану конфігурацію (мал. 1). Складний ефір тозилату використовувався для рентгенівської кристалографії, оскільки вільна сполука не кристалізується [53]. Поряд з його хімією були також розкриті психотропні властивості 1.
Зростаючий інтерес до C. sativa та її компонентів призвів до активізації досліджень в цій області і, як наслідок, появі ряду оглядів на цю тему [49, 50, 51]. Нещодавно Ахмед та ін. виділили вісім нових сполук тетрагидроканнабинольного типу [54], як показано на мал. 2. Ці нові каннабіноїди були визначені як β-fenchyl Δ9-tetrahydrocannabinolate2), α-fenchyl Δ9-tetrahydrocannabinolate3), Епі-борне Δ9-tetrahydrocannabinolate4), борне Δ9-tetrahydrocannabinolate5), α-terpenyl Δ9-tetrahydrocannabinolate6), 4-terpenyl Δ9-tetrahydrocannabinolate7), α-кадинил Δ9-тетрагидроканнабинолат8) та γ-эвдесмил Δ9-тетрагидроканнабинолат9). Їх структури (мал. 2) були встановлені на основі спектроскопічного аналізу ЯМР і ГХ-МС у вигляді моно – або сесквітерпеноїдних ефірів Δ9-тетрагідроканнабінолової кислоти а, попередника Δ9-ТГК. В умовах високої температури використовуваного аналізу GC-MS ці сполуки розпадаються на два компоненти з утворенням Δ9-ТГК і моно – або сесквітерпена. Ці складні ефіри каннабіноїдів були виділені з високоефективного C. sativa різноманітність з використанням декількох хроматографічних методів, включаючи вакуумно-рідинну хроматографію (VLC), полупрепаративную ВЕРХ C 18 і полупрепаративную энантиоселективную хиральную ВЕРХ [54]. У недавній публікації Зульфікар та ін. виділив димерний канабіноїд під назвою канабізол (10) (мал. 2) із зразків з високим вмістом каннабігеролу (21), отриманих в рамках програми моніторингу ефективності C. sativa, з використанням колоночной хроматографії з силікагелем. Аналіз GC-MS каннабізолу (10) показав два діагностичних іонних піки при m/z314 і m/z328, відповідних Δ9-ТГК і 2-метил-Δ9-ТГК [55]. Радван та ін. виділили і ідентифікували 8α-гідрокси-Δ9-тетрагідроканнабінол (11), 8β-гідрокси-Δ9-тетрагідроканнабінол (12) і 11-ацетоксі-Δ9-тетрагидроканнабиноловую кислоту А13з високоефективного зразка C. sativa[56]. Альдегід Δ 9-ТГК (14) та 8-оксо-Δ9-ТГК (15також були виділені з того ж сорту [57] (рис. 2).
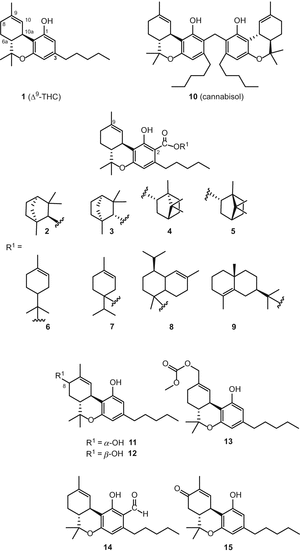
( – ) – Δ 8– транс-тетрагідроканнабінол (Δ8-ТГК) типу
Протягом багатьох років, тільки два Δ8-ТГК–типу каннабіноїдів, зокрема, Δ8–транс-тетрагідроканнабінол (16, Δ8-ТГК) і Δ8–Транс-Тетрагідроканнабінолової кислоти (17, δ8-thca) (рис. 3), були відзначені з початку хімічні дослідження с. Sativa[58, 59]. Нещодавно в нашій групі виділено три великих сполуки цього типу [55, 56], які були визначені як 10α-гідрокси-Δ8-тетрагідроканнабінол (18), 10β-гідрокси-Δ8-тетрагідроканнабінол (19) і 10Аα-гідрокси-10-оксо-δ8-тетрагідроканнабінол (20) (мал. 3).
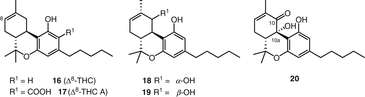
Тип каннабигерол (CBG)
Каннабігерол (21) (CBG) був першим з’єднанням, виділеним в чистому вигляді зі смоли Cannabis sativa[60]. З каннабіноїдів каннабігерольного типу до 2005 року було опубліковано вісім сполук [51], тоді як нещодавно повідомлялося про ще дев’ять нових каннабіноїдів цього типу (мал . 4). З них сім сполук (22-28) були виділені з нирок зрілої жіночої рослини високоефективного сорту C. sativa. Радван та ін. виділений 5-ацетил-4-гідрокси-каннабигерол(22), (±)-6,7-транс-эпоксиканнабигерольная кислота (23), (±)-6,7-цис-эпоксиканнабигерольная кислота (24), (±)-6,7-снд-эпоксиканнабигерол(25) та (±)-6,7-транс-эпоксиканнабигерол(26) з високоефективного C. sativa[61, 62]. Два складних ефіру каннабигероловой кислоти, γ-эвдесмил-каннабигеролат(27) та α-кадинил-каннабигеролат28), були виділені з використанням энантиоселективной ВЕРХ із одного і того ж високоефективного сорти [54]. У 2008 році Апендіно та ін. очистив нове, Полярне похідне дигідроксиканнабігеролу (кармагерол) (29) з ацетонового екстракту надземних частин C. sativaсорту “карма”. У їх процедурі екстракт C. sativa був фракціонований на RP c18колонка силікагелю з подальшою хроматографією на колонці силікагелю і подальшим використанням верх в нормальній фазі для виділення з’єднання (29)[63]. Сесквіканнабігерол (30), ліпофільний аналог каннабігеролу, був виділений Полластро та ін. з воскоподібної фракції різновиду волокнистої конопель” карма”після гідролізу воску метанольним КОН і очищення за допомогою колоночной хроматографії з силікагелем на гравітаційній колонці з подальшою хроматографією спалахом над нейтральним глиноземом [64].
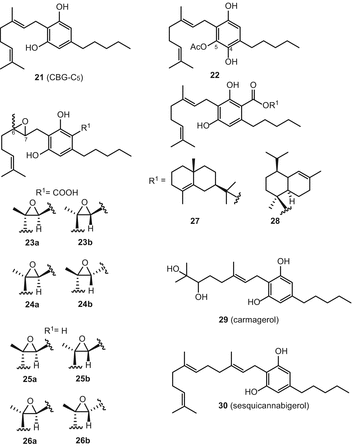
Тип каннабихромен (CBC)
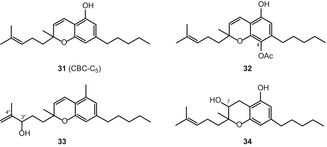
Дослідницькі групи Клауссена та ін. а Гаони і Мехулам незалежно розкрили структуру каннабихромена(31) (CBC) в 1966 році [65, 66]. Элсоли і Слейд згодом повідомили про шести каннабиноидах каннабихроменного типу [51]. У недавній публікації було описано у відриві від високоефективний с. Sativa трьох нових cannabichromene-тип канабіноїди (Мал. 5), а саме, (±)-4-acetoxycannabichromene (32), (±)-3″-гідрокси-Δ4″-cannabichromene (33) і (−)-7-hydroxycannabichromane (34), шляхом застосування гелю кремнезему вакууму-рідинної хроматографії (в VLC), а також силікагель і С18верх [62].
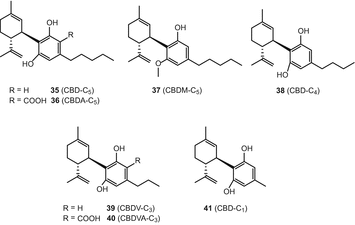
Тип каннабидиол (CBD)
Каннабідіол (35) (CBD) і каннабідіолова кислота (36) (CBDA) є основними метаболітами непсихотропних (волокнистих) різновидів C. sativa.Adams та ін. виділили каннабідіол (CBD) в 1940 році [67], в той час як Петржилка та ін. повідомили про свій синтез і абсолютну конфігурацію як (−)-транс-(1R, 6R) [68]. Сім каннабідіол-тип каннабіноїдів [(−)-каннабідіол (КБР), (35), каннабідіолова кислота (до cbda) (36), каннабідіол монометилового ефіру (CBDM) (37), каннабідіол-с4(КБР-с4) (38), (−)-cannabidivarin (Cbdv) (39), cannabidivarinic кислоти (Cbdva) (40), і cannabidiocol (КБР-с,1) (41)] були включені в огляд 2005 року, проведений Елсолі і Слейдом (мал. 6) [51]. З 2005 року не повідомлялося про нові каннабіноїди типу КБР.
Тип каннабинодиол (CBND)
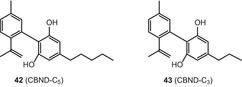
Каннабіноїди каннабіноїдного типу є ароматизованими похідними каннабідіолу (КБР). Каннабинодиол (CBND-C5) 42) та CBND-C3(каннабинодиварин) (43) (мал. 7) є єдиними двома сполуками з цього підкласу, які були охарактеризовані в C. sativa[49, 51].
Тип каннабиелсоин (CBE)
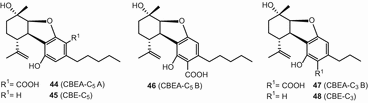
П’ять cannabielsoin (све)-тип канабіноїдів з однаковою абсолютною конфігурації (5Аз6З9Р,9АР) були описані [49], і назвав cannabielsoic кислоти (CBEA-з5А) (44), cannabielsoin (све) (45), cannabielsoic кислоти B (CBEA-з5Б) (46), cannabielsoic кислоти, Б, в3(CBEA-з3Б) (47), і C3-cannabeilsoin (КБ3-з3) 48). Ці каннабіноїдні ізоляти типу CBE були охарактеризовані з C. sativa[69]. Крім того, вони були ідентифіковані як метаболіти CBD у ссавців [70] (мал. 8).
Тип каннабициклол (CBL)
Каннабициклол (CBL) (49), каннабициклоновая кислота (CBLA) (50) та каннабицикловарин (CBLV) (51) (рис. 9) є єдиними представниками цього підкласу [71, 72, 73, 74, 75].
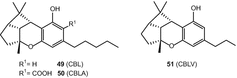
Тип каннабинол (CBN)
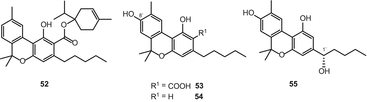
Сім похідних каннабинола були включені в огляд 2005 року [51]. Крім того, Ахмед і ін. виділено 4-терпенил каннабинолат (52) (мал. 10) з високоефективного різновиду C. sativa[54]. При аналізі GC-MS з’єднання 52фрагментувалося до CBN і монотерпенолу. Цей каннабіноїд був виділений напівпрепаративним енантіоселективним методом ВЕРХ. Крім того, 8-гідроксиканабінолова кислота а (53) і 8-гідроксиканабінол (54) (рис. 10) були виділені з того ж різновиду C. sativa[62]. З’єднання 54, яке спочатку було отримано в якості синтезованого продукту [76], було вперше виділено з природного джерела з використанням процедури твердофазної екстракції C 18 (SPE). Ахмед та ін. нещодавно повідомлялося про виділення (1-Х) – гидроксиканнабинола55) (мал. 10) з високоефективного зразка C. sativa [57].
Тип каннабитриол (CBT)
Каннабітріол був спочатку зареєстрований Обатою і Ісікава в 1966 році [77], але його хімічна структура була з’ясована десятиліттям пізніше, у 1976 році [78]. Конфігурація цього з’єднання пізніше була визначена за допомогою рентгенівського аналізу [79]. Крім того, дев’ять ТОС – тип канабіноїдів, у тому числі (−)-транс-cannabitriol ((−)-транс-БТ-с5) (56), (+)-транс-Cannabitriol ((+)-транс-ТОС-с5) (57), (±)-цис-cannabitriol ((±)-цис-ТОС-з.5) (58), (−)-транс-10-ethoxy-9-гідрокси-Δ6а(10А)-тетрагідроканнабінолу ((−)-транс-БТ-тон-с5) (59), (±)-Транс-cannabitriol-з3((±)-транс-ТОС-з3) (60), КПТ-с3гомолог (невідомо стереохімії) (ЦБТ-с3-гомолог) (61), (−)-транс-10-ethoxy-9-гідрокси-Δ6а(10а)-tetrahydrocannabivarin-з3((−)-транс-БТ-тон-з3) (62), 8,9-дигідрокси-Δ6а(10а)-тетрагідроканнабінол (8,9-Ді-о-ТМС-з5) (63), та каннабидиоловая кислота tetrahydrocannabitriol ефіру (до cbda-з59-ПРО-ТМС-з5ефір) (64) (рис. 11) були згадані в попередньому огляді [50]. Проте, два етокси каннабитриола, (−)-транс-CBT-OEt-c5(59) і (−)-транс-CBT-OEt-C3(62), ймовірно, є артефактами, оскільки етанол використовувався для їх виділення з C. sativa[80, 81].
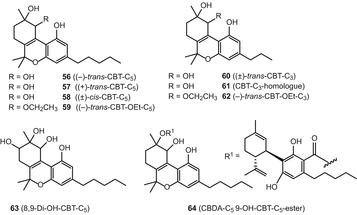
Різні типи каннабіноїдів
Різні типи каннабіноїдів були узагальнені в огляді Елсолі і Слейда [51]. Ці сполуки включені dehydrocannabifuran (DCBF-с5) (65), cannabifuran (БНВ-с5) (66), 8-гідрокси-isohexahydrocannabivirin (о-Ісо-hhcv-з3) (67), cannabichromanone-з5(CBCN-з5) (68), cannabichromanone-з3(cbcn-з3) (69) (мал. 12)
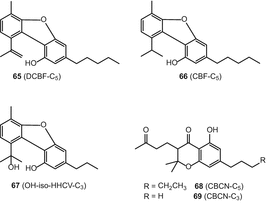
10-оксо-Δ6а(10а)-тетрагідроканнабінол (OTHC) (70), cannabicitran71), (−)–Δ9–цис-(6аз,10аР)-тетрагідроканнабінол (СНД-Δ9-ТГК) 72) cannabicoumaronone (CBCON-з5) 73) (мал. 13)
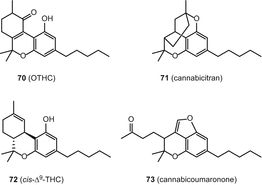
Сannabiripsol (ЦБ РФ) (74), cannabitetrol (CBTT) (75), (±)-Δ7–СНД-isotetrahydrocannabivarin-з3(СНД-ІСО-δ7-thcv) (76), (−)-Δ7–транс-(1р,3р,6р)-isotetrahydrocannabivarin-з3(транс-ІСО-Δ7-thcv) (77) і (−)-δ7–транс-(1р,3р,6р)-isotetrahydrocannabinol-з5(транс– ІСО-Δ7– ТГК) (78) (Мал. 14).
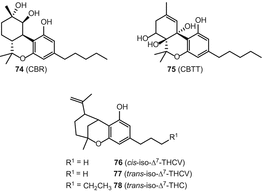
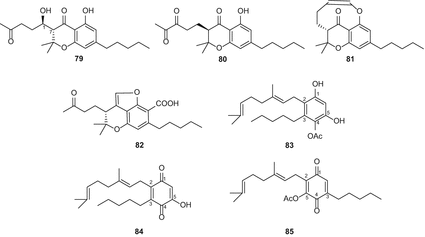
Однак у більш пізньому огляді каннабихроманоны і каннабикумарононы були виділені в окремі групи в результаті уточненої класифікації [82]. З високоефективного різновиду C. sativa, Ahmed та ін. виділили три каннабіхроманону (мал. 15), які були названі каннабіхроманонами B (79), C (80) і D (81). Абсолютна конфігурація трьох сполук була визначена на основі дериватизації складних ефірів Мошера і перевірки їх спектрів кругового дихроїзму [83]. Виділення цих сполук проводили з використанням напівпрепаративної верх C 18. (−)-(7R)-Каннабикумароновая кислота (82), 4-ацетоксі-2-geranyl-5-гідрокси-3-н-pentylphenol(83), і 2-geranyl-5-гідрокси-3-н-пентил-1,4-бензохинона(84) (мал. 15) були виділені з нирок і листя того ж різновиду конопель,за рахунок застосування ряду хроматографічних методів, в тому числі вакуумно-рідинної хроматографії (Валенсія) над силікагелем, твердофазна екстракція розділової колоні (з18оін), і нормально-фазової ВЕРХ [62]. Спектр CD (82) показавши позитивний ефект бавовни при 246 нм і негативний при 295 нм, що вказує на конфігурацію (7R) [61]. Крім того, 5-ацетокси-6-гераніл-3-н-пентил-1,4-бензохінон (85) (рис. 15) був виділений з допомогою колонковою хроматографією на силікагелі з подальшим ВЕРХ у нормальній фазі [84]. Радван та ін. класифіковане з’єднання (85) помилково як неканнабиноид [83]; однак, оскільки воно є ацетоксипохідним терпенофенолу c21, його класифікацію слід переглянути, щоб включити в клас компонентів каннабіноїдів.
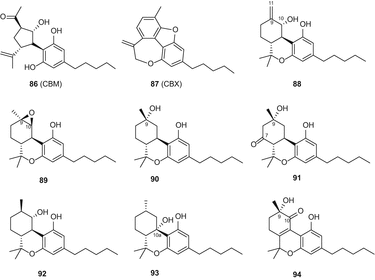
У 2010 році Тальялатела-Скафаті та ін. виділив новий канабіноїд під назвою каннабімовон (CBM) (86) (мал. 16) з непсихотропного різновиду C. sativa[85]. Цей незвичайний метаболіт, імовірно, утворюється з каннабідіолу і був виділений з полярної фракції конопель за допомогою флеш-хроматографії на силікагелі C 18 зі зворотною фазоюз подальшою верх в нормальній фазі [85]. Пагані та ін. виділив тетрациклічний канабіноїд каннабіоксепан (CBX) (87) (мал . 16) з сорту “караманьола” C. sativa[86]. Нещодавно Радван та ін. [55] і Ахмед і ін. [57] ізольовані шість канабіноїдів з високоефективний різноманітні С. Sativa, які були визначені як 10α-гідрокси-Δ9,11-hexahydrocannabinol(88), 9β10β-epoxyhexahydrocannabinol(89), 9α-hydroxyhexahydrocannabinol(90), 7-оксо-9α-hydroxyhexahydrocannabinol(91)10α-hydroxyhexahydrocannabinol(92), 10аР-hydroxyhexahydrocannabinol(93), і 9α-гідрокси-10-оксо-Δ6а,10а-тетрагідроканнабінол (94) (мал. 16).
Неканабіноїдні компоненти
На додаток до каннабіноїдів раніше з C. sativa були отримані сотні компонентів, що належать до широкого спектру хімічних класів [49, 50, 51]. На додаток до 419 раніше відомих неканабіноїдних вторинних метаболітів C. sativa, з 2005 року з цієї рослини було виділено 26 неканабіноїдів (Мал.17–23). Сім сполук, а саме, cannflavin з(95), chrysoeriol(96), 6-prenylapigenin(97), 4,5-дигідрокси-2,3 та 6-trimethoxy-9,10-dihydrophenanthrene(98), 4-гідрокси-2,3,6,7-tetramethoxy-9,10-dihydrophenanthrene(99), 4,7-диметокси-1,2,5-trihydroxyphenanthrene(100) (Рис. 17), і β-ситостерил-3-про–β–d-глюкопіранозид-2′-про-пальмітат (101) були виділені з високоефективного різновиду C. sativa[84].
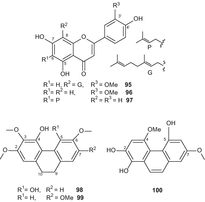
З’єднання (101) виділяли методом колоночной хроматографії в силікагелі з подальшою твердофазної екстракцією в нормальній фазі, в той час як з’єднання (96) очищали методом колоночной хроматографії в силікагелі з подальшою хроматографією в зворотній фазі. З’єднання 95, 99 і 100 були очищені за допомогою колоночной хроматографії з силікагелем, твердофазної екстракції в нормальній фазі і верх C 18. Нове з’єднання, 9,10-дигідро-2,3,5,6-тетраметоксифенантрен-1,4-Діон (102) був виділений з листя і гілок C. sativaметодом сілікагелевою хроматографії та пропускання через сефадекс LH-20 з подальшою полупрепаративной рідинної хроматографією [87]. Докозанові кислоти метилового ефіру (103) (рис . 18),
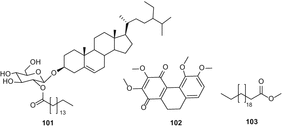
ацетил-стигмастерол 104, α-spinasterol (105), 1,3,6,7-парфумерії і т. п. Сторінка 2-з–β–д-глюкопіранозіл-ксантонами106) (мал. 19), апігенін-6,8-Ді-з–β–д-глюкопіранозиду (107), урацил (108) і quebrachitol (109) були ізольовані з петролейного ефіру і н-бутанол фракцій з метанольного екстракту конопель листя і гілки [88].
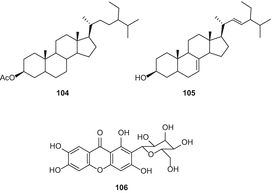
Автори вказали, що квебрахитол(109) був вперше виділений з C. sativa[88]; однак про це конкретне з’єднання вже давно повідомлялося від цього виду [49]. Цянь та ін. виділили канабсин а (110) (мал. 20), изоселахоцериановую кислоту (111, β-ситостерин 112) та маніт (113) з плодів C. sativa[89]. Ці сполуки були очищені послідовною колонкою силікагелю та колоночною хроматографією Sephadex LH-20 [89].
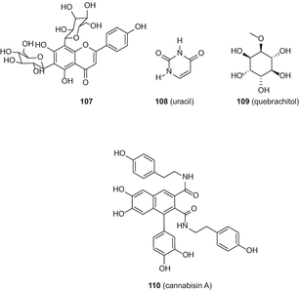
Хоча автори вперше заявили про виділення цих п’яти сполук з C. sativa[89], β-ситостерин(112) та маніт (113) раніше були описані у цього виду [49]. 5′ – метил-4-пентілбіфеніл-2,6,2′-ТРІОЛ (114) (рис . 21) і 7-метоксиканнабіспірон (115) були виділені з високоефективного різновиду C. sativaз використанням хроматографії в нормальній фазі з подальшим ВЕРХ C 18 [61].
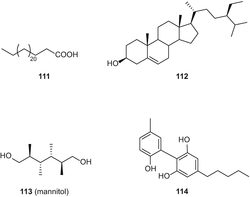
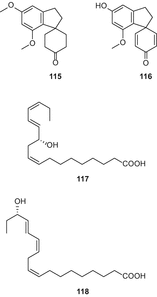
У 2011 році Пагані та ін.повідомили про виділення ізоканнабіспірадієнону (116) і двох поліненасичених гідроксижирних кислот, 117 і 118 (мал. 22), з волокнистого сорту C. sativaсорту “кармагнол” з використанням флеш-хроматографії RP-C18 і ВЕРХ у нормальній фазі [86].
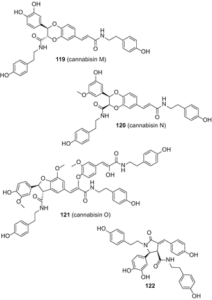
У 2015 році Ян та ін виділили чотири нових лигнанамида, каннабизин М (119), каннабизин N (120), каннабизин Про (121), та 3,3′-деметил-гелиотропамид(122) з этилацетатного екстракту насіння конопель (мал. 23), використовуючи комбінацію обернено-фазової хроматографії під середнім тиском, проходження через Сефадекс LH-20 і RP-ВЕРХ [90].
Аналіз канабіноїдів у сатіві канабісу та її похідних
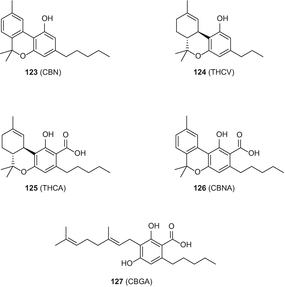
У літературі описано кілька методів аналізу сатіви канабісуі її похідних (марихуани, гашишу і гашишного масла). Ці методи були зосереджені головним чином на ідентифікації, виявленні та кількісному визначенні каннабіноїдів, включаючи як кислі, так і нейтральні речовини цього типу. Особливу увагу було спрямовано на можливі лікарські властивості, (−)-транс-Δ9-тетрагідроканнабінол (Δ9-ТГК) (1), каннабигерола (CBG) (21), каннабихромена (ПЦБ) 31), каннабидиола (CBD) (35), каннабинола (ЕЛЬБОР) (123) (Рис. 24), і тетрагідроканнабіварину (THCV) (124) (мал. 24), а також можливість використання для судово-медичних цілей [91].
Для досягнення вищезазначених цілей використовувалися різноманітні аналітичні підходи, методи та інструменти з різним рівнем чутливості і специфічності. Найбільш широко застосовуваними методами аналізу канабісубули ГХ/МС і ВЕРХ [92, 93, 94, 95, 96, 97]. Газова хроматографія / мас-спектрометрія набагато частіше використовується для цієї мети, незважаючи на властивий їй недолік, що полягає в тому, що вона викликає термічне декарбоксилювання кислих каннабіноїдів до їх нейтральної форми, якщо тільки рослинний екстракт не отриманий хімічним шляхом. На відміну від цього, верх не впливає на структуру каннабіноїдів, що дозволяє аналізувати вихідні сполуки, присутні в рослинному екстракті. Однак у нього є мінус-недостатня роздільна здатність всього спектру канабіноїдів. Нижче наведено огляд методів, описаних у літературі для аналізу C. сатівнихпохідних.
Моріта і Андо описали метод GC-MS для аналізу декількох канабіноїдів в гашишному маслі. Використовуючи цей метод, одинадцять сполук, включаючи Δ9-ТГК (1), CBC (31), CBD (35) і CBN (123) (мал. 24), поряд здеякимигомологами C3, були дозволені і ідентифіковані. У цьому звіті автори запропонували структури для фрагментів піку Δ 9-ТГК на основі їх спостережуваних мас [98].
Бреннейсен і ЭлСохли описали метод, який об’єднав капілярну газову хроматографію високого дозволу з детекцією іонізації полум’я (GC-FID) і GC-MS для ідентифікації сполук в екстрактах C. sativa, щоб встановити кореляцію між їх хімічними профілями і географічним походженням рослинних матеріалів. Аналізовані компоненти включали терпени, алкани, каннабіноїди і неканнабіноїдні феноли. Було ідентифіковано понад 100 різних сполук, і процедура виявилася надійною і застосовною при проведенні судових експертиз для визначення географічного походження C. sativa.зразки за їх хімічним профілів [99].
В іншому дослідженні ВЕРХ-УФ використовувався для вирішення сумішей кислих і нейтральних каннабіноїдів з використанням колонки Beckman Ultrasphere 3 мкм ODS. В отриманому сліді верх було виявлено більше 40 компонентів [91].
Хіда та ін. опублікована процедура класифікації сортів гашишу на основі перевірки їх профілів піролізно-газової хроматографії в присутності порошкоподібного хрому, і отримані дані згодом були піддані кластерному аналізу нормалізованих пирограм. У цій роботі піки в кожній пирограмме були нормалізовані по відношенню до присутнього найвищого піку. Результати кластерного аналізу були представлені у вигляді чітко інтерпретованих візуальних уявлень дендрограм. Дендограми можуть бути використані для порівняння невідомих зразків гашишу зі зразками з різних джерел з метою класифікації [100].
Метод GC-FID був розроблений Россом та ін. для рутинного аналізу конфіскованих зразків марихуани та кількісного визначення каннабіноїдів, включаючи Δ9-THC (1), CBG21), CBC (31), CBN (35), CBN (123) (мал. 24) і THCV (124) (мал. 24). Використовувана процедура включала екстракцію невеликої кількості зразка (100 мг) сумішшю метанолу і хлороформу (99:1), що містить внутрішній стандарт (4-андростен-3,17-діон), з подальшим прямим аналізом екстракту на колонці DB-1 [101].
Вересс та ін. повідомив про ранній метод порівняльного аналізу нейтральних каннабіноїдів за допомогою ВЕРХ з використанням двох різних типів колонок із пов’язаною фазою. У цьому дослідженні колонка з амінозв’язаною фазою використовувалася для розділення компонентів рослинного матеріалу неполярними розчинниками з використанням прямого вприскування екстракту без попереднього очищення. Результати з використанням цієї колонки порівнювалися з результатами, отриманими з використанням колонки зі зворотною фазою, де остання вимагала очищення зразка, використовуючи C18-Картридж Sep-Pak перед аналізом верх. Було показано, що використання колонки з амінозв’язку перевершує колонку зі зворотною фазою для кількісного визначення нейтральних каннабіноїдів [102].
кілька аналітичних методів, включаючи TLC, GC-FID з упакованими і капілярними колонками і верх, були детально описані для аналізу нейтральних і кислих каннабіноїдів в продуктах C. sativa (марихуана, гашиш і гашишное масло) в посібнику, підготовленому в 1987 році Відділом наркотичних засобів Організації Об’єднаних Націй [103]. Це керівництво включало добірку методів відбору проб та аналізу продуктів C. sativa, рекомендованих для використання національними лабораторіями з наркотиків. Кількість ТГК (1) в олії насіння конопель визначали за допомогою аналітичної процедури GC-MS, опублікованої босі і Коулом [104]. Зміст Δ9– ТГК (1) і тетрагідроканнабінолової кислоти (ТГК) (125) (мал. 24) у продуктах, що містять коноплю, визначали методом ВЕРХ [105]. Крім того, загальнірівні концентрації Δ 9-ТГК (1) як в насінні C. sativa лікарського, так і волокнистого типубули визначені Россом та ін. слідуючи процедурі GC-MS [106]. Pellegrini et al. опублікував метод, що поєднує рідинно-рідинну екстракцію з GC-MS для кількісного визначення Δ9-ТГК (1), CBD (35) і CBN (123) (мал. 24) в різних продуктах і напоях, що містять коноплю. Дієтичними продуктами, включеними в це дослідження, були пиво, пастила, лікер, насіння, запашна трава і масло. У цій процедурі, в якій Δ 8– ТГК (16) використовувався в якості внутрішнього стандарту, тверді і рідкі зразки екстрагували гексанами/ізопропанолом (9:1) і аналіз проводили на капілярній колонці з плавленого кремнезему. Силільовані зразки аналізували в режимі моніторингу вибраних іонів (SIM). Було встановлено, що рівні кількісної оцінки становлять 1 нг/г для Δ9-ТГК і CBN і 2 нг / г для CBD. Рівні Δ9-вміст ТГК в різних продуктах з конопель варіювався в 50 разів. Отримані дані показали, що більшість проаналізованих зразків були отримані з канабісу наркотичного типу[107].
Кількісна оцінка окремих каннабіноїдів вимагає використання внутрішніх стандартів, які варіюються в залежності від використовуваного методу. Вони включали використання вуглеводнів з довгим ланцюгом (наприклад, n-тетрадекан або n-докозан), стероїдів (андрост-4-ен-3,17-діон і холестан) і фталатів (дибензилфталат або ді-n-октилфталат) [91].
В іншому опублікованому дослідженні, ВЕРХ, з використанням обращенно-фазової колонки (7 мкм розмір частинок) і суміш метанолу і 0,01 мсірчаної кислоти (80:20), в якості рухомої фази була використана при аналізі Δ9-ТГК (1), КБР (35), та кубічним нітридом бору (123), разом з їх відповідної карбонової кислоти форм, тетрагідроканнабінолової кислоти (THCA) (125) (мал . 24), каннабідіолова кислота (до cbda) (36) і cannabinolic кислоти (ЦБА) (126) (рис. 24). Автори застосували стандартні умови зберігання зразків гашишу разом з чистими каннабиноидами і прийшли до висновку, що загальні значення CBD/CBDA-C5, CBN/CBNA і Δ9-THC/THCA були корисні для оцінки зразків гашишу [108].
Хазекамп і партнери розробили спектроскопічний метод 1 Ч-ЯМР для кількісного аналізу каннабіноїдів в C. sativa. Було виявлено, що відмінні сигнали для каннабіноїдів знаходяться в діапазоні δh4,0–7,0 проміле від 1Спектр Н-ЯМР, з використанням антрацену в якості внутрішнього стандарту. Кількісне визначення цільових сполук було досягнуто шляхом обчислення відносного відношення площ піків обраних протонних сигналів цільового з’єднання до відомої кількості внутрішнього стандарту. Цей метод дозволяє проводити просте і швидке кількісне визначення канабіноїдів без попередньої хроматографічного очищення, займаючи всього 5 хвилин часу аналізу [109].
Еліас і Лоуренс в книзі з аналізу наркотиків, що викликають зловживання, опублікованій в 1991 році, представили короткий огляд інструментальних методів, використовуваних при припиненні незаконного обігу наркотиків. Методи, що використовуються для виявлення прихованих наркотиків, були розділені на два основні методи, засновані на масовому виявленні та відборі проб повітря. Методи об’ємного виявлення включали рентгенівську візуалізацію, зворотне гамма-розсіювання, активацію теплових нейтронів та інші системи, в той час як методи відбору проб повітря включали виявлення парів ацетону, мас-спектрометрію, газову спектрометрію і спектрометрію іонної рухливості. Автори дійшли висновку, що всі ці методи мають обмеження і недоліки, і запропонували необхідність більш ефективних і виборчих методологій [110].
У недавньому звіті описано метод одночасного кількісного визначення Δ9-ТГК (1), каннабидиола (CBD) (35), каннабинола (CBN) (123) (мал. 24), коли він присутній в C. sativa, з використанням послідовної хроматографії з силікагелем і верх в зворотній фазі. Стадію колоночной хроматографії використовували для очищення розчинного в метанолі екстракту C. sativa[111].
Опубліковано метод ВЕРХ-УФ із зворотною фазою (виявлення при 220 нм) для одночасного визначення Δ9-ТГК (1), каннабидиола (CBD) (35) і каннабинола (CBN) (123) (рис. 24) C. C. sativa[112]. Діапазон виявлення був встановлений на рівні 3,75–37,5 нг см-3, 0,125–1,25 нг см-3і 0,735-7,35 нг см-3для D9– ТГК, CBD і CBN відповідно. Ці середні показники відновлення склали 96,1, 97,2 98 98,0% δ δ 9-CBD, CBD CB CBN [112].
Розроблено методику на основі верх/ТАТО для ідентифікації, а також кількісного визначення D9-ТГК (1, Δ8-ТГК (16), ЦБС (21), КБР (35), до CBDA (36), КНБ (123(фіг. 24), THCA (125) (.. у цьому випадку, якщо ви є власником домену-увійдіть в систему для продовження терміну служби. 24)) – -,,, <.. Сатіва. Для встановлення оптимальних аналітичних умов використовувалися прогностичні полілінійні моделі. Β, β β-β. Автори стверджували,,, <C. sativa[41].
Розроблена нормально-фазовою високоефективною ТШХ-денситометричного методу визначення та ідентифікації основних нейтральних канабіноїдів [Δ9-ТГК (1″), ЦБС (21), ПГС (31), КБР (35″), і thcv (124) (рис. 24)], δ δ 9-((123) (.. 24)) C. C.C.. Декарбоксилювання δ9-((125) (.. 24) 100 100°C 2 2,,.. Cam camag.. Діапазон кількісного визначення був визначений як 50-500 нг з використанням ультрафіолетового світла при 206 нм для виявлення. Результати цього методу показали,,, – – – C. sativa[113].
Проведено дослідження з хроматографічного та спектроскопічного аналізу 16 основних канабіноїдів. ,, GC, GC-MS MS,.. Аналіз GC-MS,,–[[93].
Цей процес заснований на взаємодії канабіноїдів з перманганатом калію в кислих умовах для отримання ефекту хемілюмінесценції. Цей метод у поєднанні з верх використовувався для визначення каннабідіолу . Автори дійшли висновку, δ δ9-((1)) C. C. sativa<[114].
C. sativa, 18 C 18 [115]. Каннабіноїди, які були залучені в аналіз включені Δ9-ТГК (1, Δ8-ТГК (16), ЦБС (21), ПГС (31), КБР (35), до cbda (36), cannabicyclol (КБР) (49), КНБ (123), THCV (124), THCA (125), CB cbga (127). Поділ суміші канабіноїдів було досягнуто за 22,2 хв. Закономірності концентрації-реакції процесу демонстрували лінійні залежності між концентраціями та областями піків [115].