Зміст
Препарати Cannabis sativa L. використовуються в медицині протягом тисячоліть. Однак занепокоєння щодо небезпеки зловживання призвело до заборони використання марихуани в медицині в більшості країн у 1930-х роках. Лише нещодавно марихуана та окремі природні та синтетичні агоністи та антагоністи канабіноїдних рецепторів, а також хімічно споріднені сполуки, механізм дії яких досі невідомий, знову стали вважатися терапевтичною цінністю. Однак їх використання дуже обмежено. Незважаючи на легку залежність від канабісу та можливе посилення звикання до інших речовин, які зловживають, у поєднанні з канабісом терапевтична цінність канабіноїдів є занадто високою, щоб її можна було відкинути. Численні захворювання, такі як анорексія, блювота, біль, запалення, розсіяний склероз, нейродегенеративні розлади (хвороба Паркінсона, Хантінгтона, синдром Туретта, хвороба Альцгеймера), епілепсія, глаукома, остеопороз, шизофренія, серцево-судинні розлади, ожиріння -пов’язані з цим розлади, і це лише деякі з них, лікуються або мають потенціал для лікування агоністами/антагоністами канабіноїдів/сполученнями, пов’язаними з канабіноїдами. З огляду на дуже низьку токсичність і загалом доброякісні побічні ефекти цієї групи сполук, нехтування або заперечення їх клінічного потенціалу є неприпустимим – натомість нам потрібно працювати над розробкою більш селективних агоністів/антагоністів канабіноїдних рецепторів та споріднених сполук, як а також на нових препаратах цієї родини з кращою селективністю, закономірностями розподілу та фармакокінетикою, і – у випадках, коли неможливо відокремити бажану клінічну дію та психоактивність, – просто для ретельного моніторингу цих побічних ефектів.
Препарати Cannabis sativa L., такі як марихуана, гашиш і дагга, використовувалися в медицині протягом тисячоліть. Дослідження хімії каннабісу почалися в середині 19 століття, слідуючи головній тенденції в хімічних дослідженнях того часу, яка зосереджено на пошуку активних натуральних продуктів. Численні алкалоїди були виділені в чистому вигляді або частково охарактеризовані. Морфін, кокаїн, стрихнін та багато інших були очищені та використані в медицині. Проте більшість терпеноїдів — основного класу вторинних рослинних метаболітів, до яких належать і рослинні канабіноїди — не були виділені до кінця століття чи навіть набагато пізніше, і в багатьох випадках їхня чистота була сумнівною.
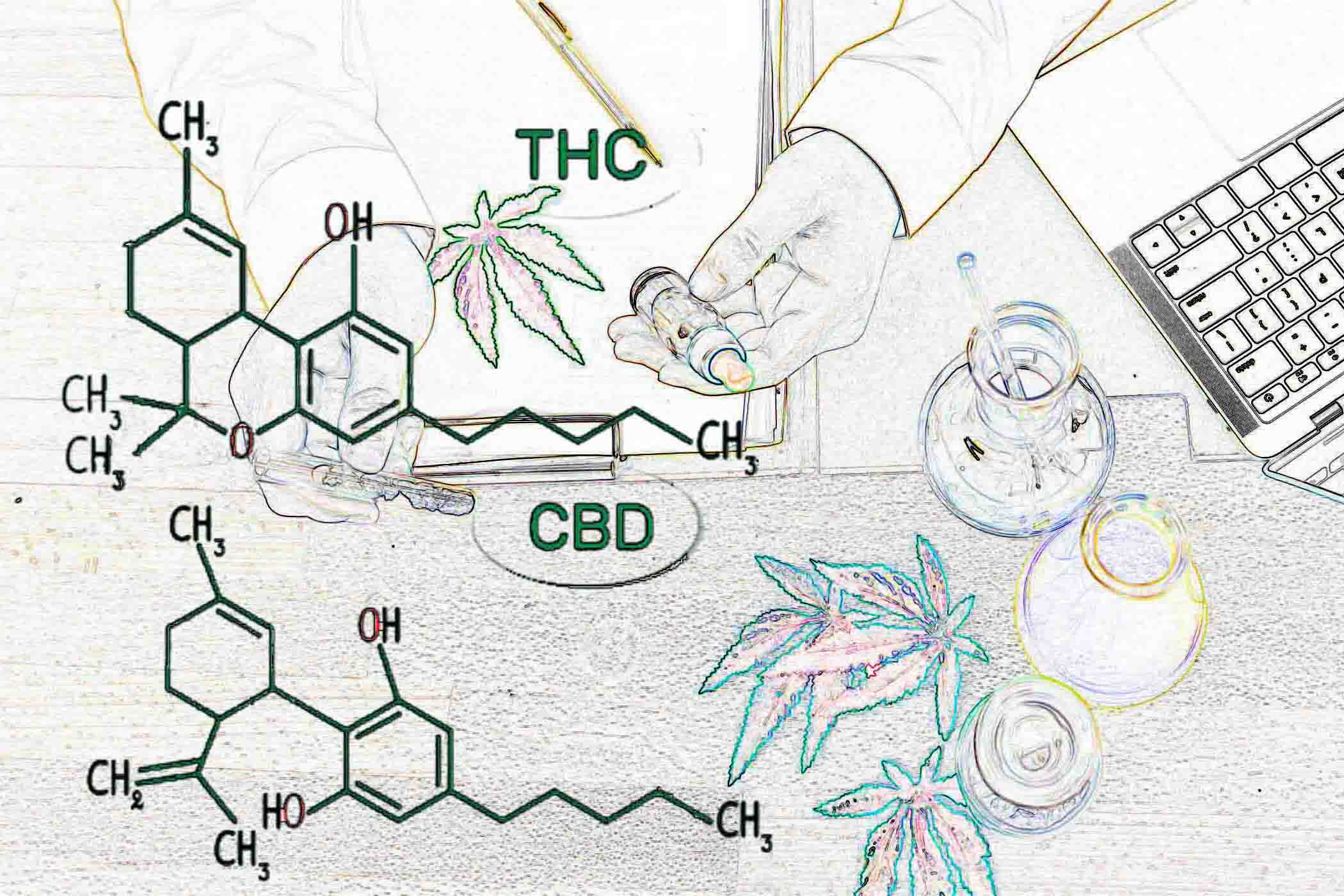
Шлезінгер був, напевне, першим дослідником, який у 1840 році отримав активний екстракт з листя і квіток коноплі. Кілька років потому Декуртив описав приготування етанольного екстракту, який при випаровуванні розчинника давав темну смолу, яку він назвав «канабіна». Детальну історію ранніх досліджень канабісу див. тут. Хімічні дослідження рослинних канабіноїдів та їх похідних протягом майже двох століть описані тут. Однак лише в 1964 році ∆9-тетрагідроканабінол (∆9- ТГК), основний психоактивний компонент канабісу, був виділений в чистому вигляді, і його структура була з’ясована. Невдовзі після цього він був синтезований і став широко доступним. Ці хімічні досягнення привели до лавини публікацій про ∆9-THC, а також про канабідіол (CBD), непсихоактивний рослинний канабіноїд. Однак занепокоєння щодо небезпеки зловживання призвело до заборони марихуани та її складових для використання в медицині. у США та багатьох інших країнах у 1930-х і 1940-х роках. Минули десятиліття, поки канабіноїди знову почали розглядати як сполуки, що мають терапевтичну цінність, і навіть зараз їх використання дуже обмежено. Тут ми представляємо огляд звикання та побічних ефектів канабіноїдів у порівнянні з їх терапевтичним потенціалом.
Звикання до канабісу та вплив канабісу на звикання до інших речовин
Марихуана може викликати легку залежність у людей. Було показано, що це залежить від типу особистості наркоманів, і може бути успішно звернене утримуванням або лікуванням за допомогою когнітивно-поведінкової терапії без виникнення серйозних симптомів відміни. Канабіноїди діють на процеси винагороди в мозку та поведінку, пов’язану з винагородою, за механізмом, подібним до того, що трапляються з іншими наркотиками, що викликають звикання. У моделях на тваринах вони підвищують винагороду за електричну стимуляцію мозку в ланцюгах нагороди головного мозку mezo-accumbens і нейронної активації основного компонента дофаміну (DA) і таким чином підвищують ланцюг DA. У релевантному для нагороди ланцюзі DA meso-accumbens. На деяких тваринних моделях вони місцями викликають обумовлену перевагу (CPP) та самоуправління. Інші дослідження, однак, виявили, що THC є поганим або дуже незначним підсилювачем залежності.
Як канабіноїди впливають на зловживання іншими речовинами. Система канабіноїдів бере участь у поведінці при споживанні алкоголю. Було виявлено, що агоністи канабіноїдного рецептора CB1 специфічно стимулюють споживання алкоголю тайого мотиваційні властивості у щурів. Висока перевага етанолу у молодих мишей знижується антагоністом канабіноїдного рецептора 1 (CB1) SR141716A (римонабант) до рівнів, що спостерігаються при виведенні за допомогою рецепторів CB1. Вивільнення дофаміну, викликане етанолом у мозку, було знижено за допомогою SR141716A, що частково може пояснити протидіючий ефект препарату. Кокаїн є ще одним об’єктом зловживанням, у придбанні та консолідації якого можуть бути залучені канабіноїди. У пацієнтів з кокаїновою залежністю можна виявити високу поширеність алкогольної залежності та залежності від канабісу. Куріння марихуани підвищує рівень кокаїну в плазмі крові також є суб’єктивні повідомлення про ейфорію у чоловіків-добровольців. Крім того, нещодавнє генетичне дослідження виявило зв’язок між повторенням n триплетів. поліморфізм гена CB1, що кодує CNR1, і залежність від кокаїну в африкансько-карибської популяції. В іншому дослідженні було виявлено, що відмова від повторного впливу кокаїну, а потім відновлення поведінки, пов’язаної з вживанням кокаїну, або сенсибілізована локомоторна реакція на одиничний випадок вживання кокаїна, відповідно, була значно зменшена завдяки попередньому лікуванню римонабантом. Аналогічно, гостре введення римонабанту блокувало вираження нікотин-індукованого обумовленого перевагою місцевості. Римонабант також зменшує самовведення нікотину і може бути ефективним не лише як засіб для припинення куріння, але також у підтримці утримання. Як ендоканабіноїдна система m відіграє певну роль у нікотиновій залежності, потенціал антагоністів канабіноїдів для її лікування очевидний. Опіатні та CB1 рецептори спільно експресуються в прилеглому ядрі та дорсальному смугастому тілі, і взаємодія між цими двома системами добре відома. Зміцнюючі властивості морфіну та тяжкість синдрому відміни сильно знижені у мишей з враженим CB1; це спостереження відкриває можливість лікувати опіатну залежність за допомогою римонабанта, як зазначається при залежності від алкоголю, кокаїну та нікотину.
Негативний вплив канабісу, крім залежності
Існують деякі негативні наслідки вживання канабісу, крім залежності, більшість із них пов’язані зі змінами уваги та когнітивних функцій або іншими нейропсихологічними та поведінковими ефектами. Більшість із них відзначаються як результат раннього вживання канабісу (у підлітковому віці). Електрофізіологічні заходи виявили тривалий дефіцит уваги серед споживачів канабісу. В іншому дослідженні було виявлено порушення як когнітивних функцій, так і настрою після вживання канабісу. Однак ще в одному дослідженні користувачі канабісу та контрольні особи однаково добре виконували завдання для перевірки робочої пам’яті та вибірково уваги. Крім того, споживачі канабісу не відрізнялися від контрольної групи з точки зору загальних моделей мозкової активності, для регіонів задіяних у цих когнітивних функціях. Пренатальний вплив канабісу пов’язаний лише з незначними порушеннями когнітивних функцій і уваги. При вживанні канабісу в підлітковому віці, зростає ризик розвитку психозів, подібних до шизофренії. Когнітивна дисфункція, пов’язана з тривалим або важким вживанням канабісу, багато в чому схожа з когнітивними ендофенотипами, які були запропоновані як маркери вразливості при шизофренії. Крім того, існують докази того, що вживання канабісу може викликати гострий шизофренічний психоз. Було виявлено, що конопля викликає широкий спектр тимчасових симптомів поведінки та когнітивних дефіцитів у здорових людей, які нагадують деякі аспекти ендогенних психозів. Амотиваційний синдром – це хронічний психічний розлад, що характеризується різноманітними змінами особистості, емоції та когнітивні функції, такі як відсутність активності, вихід усередину, апатія, незв’язність, притуплений афект, нездатність зосередитися та порушення пам’яті. Синдром був вперше описаний у 1960-х роках серед пацієнтів із тривалим вживанням канабісу. Корисну тваринну модель для цього захворювання було знайдено у щурів, де іммобілізація, подібна до канабісу, пов’язана зі зменшенням катехоламінергічних і серотонінергічних нейронів в прилеглому ядрі та мигдалеподібному ядрі, і, таким чином, може служити моделлю для синдрому амотивації. В іншому дослідженні було виявлено, що інтенсивне вживання канабісу викликає синдром амотивації у підлітків. Нещодавно було переглянуто лікування розладів, пов’язаних із вживанням канабісу. Однак виникнення синдрому амотивації в результаті впливу канабісу залишається спірним. Дані інших досліджень не підтверджують гіпотезу про те, що марихуана погіршує мотивацію. Хоча більшість негативних ефектів, пов’язаних з канабісом, пов’язані з її нейропсихологічним та поведінковим впливом, іноді зустрічаються інші негативні реакції на каннабіс. Наприклад, конопля може викликати гострий панкреатит, хоча точний механізм досі залишається невідомим.
Терапевтичне використання канабіноїдів
Ожиріння, анорексія, блювота
Протягом століть було відомо, що конопля підвищує апетит і споживання їжі. Зовсім недавно ця схильність препарату була підтверджена, було показано, що рецептор CB1 відіграє роль у централізованному контролі апетиту, периферійному метаболізмі та регуляції маси тіла. Генетичні варіанти для гену CNR1, що кодує CB1, асоціюються з фенотипами, пов’язаними з ожирінням у чоловіків. У тварин антагонізм рецепторів CB1 знижує мотивацію до смачної їжі. Введення римонабанту спричиняло пригнічення споживання напою зі смаком шоколаду протягом 21-денного періоду лікування без будь-якого явного розвитку толерантності. Було виявлено, що рецептори CB1 переважно залучені до підсилювального ефекту солодкого порівняно з підсилювачем смаку чистого жиру. Римонабант вибірково зменшує рівень споживання солодкого, а не регулярне споживання їжі загалом у приматів, що свідчить про те, що римонабант більш активний щодо гедонічних, а не поживних властивостей дієт.
Римонабант призводить до значної втрати ваги у людей з ожирінням. Лікування римонабантом також було пов’язано з сприятливим впливом на різні метаболічні параметри та серцево-судинні фактори ризику, пов’язані із зайвою вагою. У клінічних дослідженнях було виявлено, що римонабант викликає значну середню втрату ваги, зменшення окружності талії, підвищення рівня холестерину ЛПВЩ, зниження рівня тригліцеридів та підвищення рівня адипонектину в плазмі крові. Пацієнти, які перейшли з лікування римонабантом на плацебо після 1-річного лікування, відновили вагу, тоді як ті, хто продовжував приймати римонабант, зберігали втрату ваги та сприятливі зміни кардіометаболічних факторів ризику. Було показано, що Римонабант безпечний та ефективний у лікуванні комбінованих серцево-судинних факторів ризику куріння та ожиріння. Він також зменшує резистентність до інсуліну та зменшує поширеність метаболічного синдрому. Багато метаболічних ефектів, включаючи збільшення адипонектину, відбуваються за межами втрати ваги, що свідчить про прямий периферичний ефект римонабанту. Терапія римонабантом також пов’язана зі сприятливими змінами ліпідів сироватки та покращенням контролю глікемії при цукровому діабеті 2 типу. Активність римонабанту для лікування ожиріння було описано в останніх оглядах. Він був схвалений для лікування ожиріння в Європейському Союзі і продається під торговою назвою Acomplia. Дивно, але Управління з контролю за продуктами і ліками США відмовилося схвалювати римонабант, насамперед через його незначний потенціал посилювати тривожність і суїцидальні думки. До такого рішення могла призвести атмосфера жаху щодо можливих судових позовів через побічні ефекти.
Інша сторона тієї ж медалі – анорексія. Якщо в популяціях з ожирінням втрата ваги є основною метою, то для інших груп населення, таких як хворі на рак або СНІД, це величезна проблема. Дронабінол (синтетичний ТГК, відомий як марінол і схвалений для лікування нудоти та блювоти у хворих на рак і СНІД) пов’язаний із постійним покращенням апетиту. Виявилося, що він безпечний та ефективний при анорексії, пов’язаній із втратою ваги у пацієнтів зі СНІДом. , це пов’язано з підвищенням апетиту, покращенням настрою та зменшенням нудоти. У клінічних дослідженнях вага була стабільною у пацієнтів з дронабінолом, тоді як одержувачі плацебо втратили вагу. Дронабінол був безпечним та ефективним для лікування синдрому виснаження ВІЛ, а також у пацієнтів з хворобою Альцгеймера і з поширеним раком. Розглянуто можливі механізми цих дій. Каннабіноїди мають позитивний ефект у боротьбі з хворобами, пов’язаними з хіміотерапією. Вони є більш ефективними протиблювотними засобами, ніж антагоністи дофамінових рецепторів, такі як препарати типу хлорпромазину. Прямі порівняння з серотоніном (5-HT )3 антагоністи, які широко використовуються як протиблювотні засоби, не повідомлялися. Однак, хоча ці антагоністи не ефективні при уповільненій блювоті, відомо, що ТГК зменшує цей побічний ефект хіміотерапії.
Біль
Коноплі тисячоліттями використовували як знеболюючу речовину. Докази свідчать про те, що канабіноїди можуть виявитися корисними для модуляції болю, пригнічуючи передачу нейронів у шляхах болю. Беручи до уваги виражені антиноцицептивні ефекти канабіноїдів, їх було запропоновано як багатообіцяючий терапевтичний підхід для клінічного лікування невралгії трійчастого нерва. Було виявлено, що THC, CBD і CBD-диметилгептил (DMH) блокують вивільнення серотоніну з тромбоцитів в плазмі, отриманої від пацієнтів під час нападу мігрені. Однак, в інших повідомленнях, канабіноїди значно менш успішно знімають біль. У клінічному дослідженні ТГК не мав суттєвого впливу на триваючий та пароксизмальний біль, алодинію, якість життя, показники тривоги/депресії та функціональний вплив болю. Ці результати не підтверджують загальну користь ТГК для болю та якості життя у пацієнтів із рефрактерним нейропатичним болем. Аналогічно, у додатковому клінічному дослідженні не було знайдено доказів знеболюючого ефекту перорального ТГК на післяопераційний біль у людей. Інші дослідження показують набагато кращі результати полегшення болю. Коли ТГК вводили пацієнту з сімейною середземноморською лихоманкою, з хронічним рецидивуючим болем і шлунково-кишковим запаленням, було відмічено дуже значне зменшення болю. Помірне поліпшення було відзначено при застосуванні ліків на основі канабісу для лікування хронічного болю, пов’язаного з відривом кореня плечового сплетення. У пацієнтів з невропатичним болем середня інтенсивність спонтанного болю була значно нижчою при лікуванні ТГК, ніж при лікуванні плацебо, а середній показник полегшення болю (числова шкала оцінок) був вищим. Він також був ефективним при лікуванні центрального болю. Введення одноразової дози перорально пацієнтам з болем при раку, ТГК продемонстрував легкий знеболюючий ефект. Пацієнти, які страждають від болю, також схильні до самолікування марихуаною. Під час анонімного перехресного опитування (35 %) пацієнтів із хронічним нераковим болем повідомили, що вживали канабіс для полегшення болю. Пацієнти зі СНІДом, які отримували лікування канабісом, повідомили про покращення апетиту, болі в м’язах, нудоту, тривогу, нервовий біль, депресію та парестезії. Не тільки ТГК, але й інші канабіноїди потенційно можуть впливати на різні види болю. Набілон — це синтетичний канабіноїд, схвалений для лікування сильної нудоти та блювоти, пов’язаних із хіміотерапією раку. У Канаді, Сполучених Штатах та Великобританії набілон продається як Cesamet. Значне зменшення болю, пов’язаного зі спазмами, у пацієнтів із хронічним синдромом верхніх мотонейронів (УМНС), було виявлено при застосуванні набілону. Інший канабіноїд, аюлемінова кислота (AJA), був ефективним у зменшенні хронічного нейропатичного болю, незважаючи на побічні ефекти канабіноїдів (втома, сухість у роті, обмеження концентрації уваги, запаморочення, пітливість). Також були зафіксовані каннабіміметичні ефекти адюлемінової кислоти на гризунах.
Комбінація THC з непсихотропною складовою канабісу CBD має вищу активність, ніж THC окремо. Букальний спрей CBD/THC (Sativex) був визнаний ефективним у лікуванні нейропатичного болю при розсіяному склерозі (MS). Хронічний невропатичний біль також може лікуватися екстрактами канабісу, що містять THC або CBD, або Sativex. Останній також був ефективним у зменшенні порушень сну у таких пацієнтів і переважно добре переносився. Sativex є першим лікарським засобом на основі канабісу, який пройшов традиційну клінічну розробку і бутв затвердженим як ліки за рецептом. Він ефективний і добре переноситься при лікуванні симптомів розсіяного склерозу, зокрема спастичного та нейропатичного болю. Sativex було схвалено для застосування при невропатичних болях через розсіяний склероз в Канаді [огляди про Sativex та біль див. у посиланнях *, * , *].
Розсіяний склероз, нейропротекція, запалення
Вважається, що в патогенезі РС беруть участь запалення, аутоімунна відповідь, демієлінізація та пошкодження аксонів. Все більше доказів підтверджують ідею про сприятливий вплив канабіноїдних сполук на лікування цього захворювання. У клінічних дослідженнях було показано, що похідні канабісу діють проти болю, пов’язаної з РС. Однак це не єдиний позитивний ефект канабіноїдів при цьому захворюванні. При експериментальному аутоімунному енцефаломієліті щурів (ЕАЕ), лабораторна модель РС, ТГК, введена одноразово після початку захворювання, значно знижувала максимальну оцінку ЕАЕ. Зменшення запальної реакції в головному та спинному мозку також було відмічено у тварин, які отримували дексанабінол (HU-211, непсихоактивний синтетичний канабіноїд). В іншому дослідженні на щурах у всіх тварин, які отримували плацебо, розвинувся тяжкий клінічний EAE і понад 98 % померли, тоді як тварини, які отримували ТГК, не мали клінічних ознак, або були слабкі, із відстроченим початком з виживанням понад 95 %. WIN-55,212-2, інший синтетичний канабіноїд, також покращував клінічні ознаки ЕАЕ та зменшував клітинну інфільтрацію спинного мозку, частково через CB2. Використовуючи хронічну модель РС у мишей, було показано, що клінічні ознаки та пошкодження аксонів у спинному мозку зменшуються синтетичним канабіноїдом HU210. Щоб більш повно зрозуміти залучення було досліджено ендоканабіноїдну систему при РС, статус канабіноїдних рецепторів CB1 і CB2 і ферменту амід гідролази жирних кислот (FAAH) у зразках тканини мозку, отриманих від хворих на РС. Було виявлено, що селективна гліальна експресія канабіноїдних рецепторів CB1 і CB2 і ферменту FAAH індукується в MS. У мишей з хронічним рецидивуючим експериментальним алергічним енцефаломієлітом (CREAE), хронічною моделлю РС, яка відтворює багато патологічних ознак захворювання людини, виявлено помірне зниження щільності рецепторів CB1 в хвостато-путаменному, блідому кулі та мозочку. Ці спостереження можуть пояснити ефективність агоністів канабіноїдів у покращенні рухових симптомів (спастичність, тремор, атаксія), типових для РС як на моделях людей, так і на тваринах. Спастичність є поширеним неврологічним станом у пацієнтів з РС, інсультом, церебральним паралічем або травмами. спинний мозок. Уже в 1980-х роках марихуану запропонували для лікування спастичності м’язів. У експерименті на мишах було виявлено, що контроль спастичності на моделі РС опосередковується CB1, але не CB2, канабіноїдними рецепторами. У клінічних дослідженнях пацієнтів при лікуванні ТГК спостерігалося значне покращення показників спастичності порівняно з плацебо. В одному звіті про випадки набілон покращував м’язові спазми, ніктурію та загальне самопочуття після викурювання сигарети з марихуаною. ТГК значно зменшив спастичність за клінічними вимірюваннями. Відповіді були різноманітними, але користь спостерігалася у пацієнтів з тонічними спазмами. На прогресуючому етапі захворювання оральний і ректальний ТГК зменшував спастичність, ригідність і біль, що призвело до покращення активної та пасивної рухливості. Однак в інших клінічних дослідженнях виявилося, що канабіноїди зменшували тремор, але були неефективними при спастичності. Більше того, в одному дослідженні куріння марихуани ще більше погіршило поставу та рівновагу у пацієнтів зі спастичним РС. Відзначені суперечливі ефекти могли бути пов’язані з дозозалежністю. Поліпшення рухової координації спостерігалося, коли пацієнтам з РС, серйозним інвалідами з тремором і атаксією, вводили THC перорально. В іншому дослідженні екстракт канабісу не викликав функціонально значущого поліпшення тремору, асоційованого з РС. Придушення набутого маятникового ністагму (мимовільного руху очей) спостерігався у пацієнта з РС після куріння смоли канабісу, але не після прийому таблеток набілону або пероральних капсул, що містять масло канабісу. Також є результати, що свідчать про клінічний вплив канабісу на епізоди нетримання сечі у пацієнтів із MS. При лікуванні РС, а також при зменшенні болю, описаному раніше, є перевага комбінації THC+CBD (Sativex). Суміш 2,5 мг THC і 0,9 мг канабідіолу (CBD) знижує частоту спазмів і підвищену рухливість із терпимими побічними ефектами у пацієнтів із РС зі стійкою спастичною хворобою, які не реагують на інші препарати. D балів спастичності в порівнянні з плацебо. Тривале застосування Sativex зберігає свій ефект у тих пацієнтів, які відчули початкову користь. Cпочатку повідомлялось, що канабіноїди не мали сприятливого впливу на спастичність; однак було об’єктивне поліпшення рухливості, і деякі пацієнти повідомили про поліпшення болю. Пізніше ця ж група також виявила позитивний вплив на спастичність м’язів при тривалому лікуванні. Суб’єкт був ретельно перевірений.
РС — не єдине захворювання, де можна побачити нейропротекторний потенціал канабіноїдів. У експериментах на тваринах через 2 тижні після застосування 6-гідроксидофаміну відзначалося значне зниження вмісту дофаміну та зниження активності тирозингідроксилази в ураженому смугастому тілі, що супроводжувалося зниженням тирозингідроксилази-месенджера рівнів рибонуклеїнової кислоти (мРНК) у чорній речовині. Щоденне введення ТГК протягом 2 тижнів спричинило значне незворотне зменшення величини цих змін, що може мати значення при лікуванні хвороби Паркінсона (див. нижче). Каннабіноїди мають нейропротекторну активність не тільки in vitro, але й in vivo: HU -210, потужний синтетичний аналог ТГК, збільшує виживання клітин гранул мозочка миші, підданих впливу 6-гідроксидопаміну. У моделі експериментального інсульту римонабант зменшив об’єм інфаркту приблизно на 40 %. Римонабант надавав нейропротекцію незалежно від ефекту блокування канабіноїдних рецепторів. У клінічних дослідженнях пацієнти, які отримували дексанабінол, досягли значно кращого контролю внутрішньочерепного тиску/церебрального перфузійного тиску без загрози артеріального тиску. Також спостерігалася тенденція до швидшого та кращого неврологічного результату. Однак у подальших експериментах було виявлено, що дексанабінол не був ефективним у лікуванні черепно-мозкової травми. Було показано, що широкий спектр канабіноїдів допомагає при патологіях, що впливають на центральну нервову систему (ЦНС) та інші захворювання, які супроводжуються хронічним запаленням. У моделі хронічного запалення мозку гризунів, викликаного введенням ліпополісахариду в четвертий шлуночок молодих щурів, агоніст канабіноїдів WIN-55212-2 зменшував кількість LPS активованого мікроглія. Пряме придушення аутоімунного запалення ЦНС спостерігалося шляхом активації рецепторів CB1 на нейронах і рецепторів CB2 на аутореактивних Т-клітинах.
Атеросклероз є хронічним запальним захворюванням і є основною причиною серцевих захворювань та інсульту в західних країнах. Пероральне лікування низькою дозою ТГК пригнічує прогресування атеросклерозу в моделі мишей з нокаутом аполіпопротеїну Е завдяки плейотропному імуномодулюючому впливу на лімфоїдні та мієлоїдні клітини. Таким чином, THC може бути цінною мішенню для лікування атеросклерозу. N-пальмітоілетаноламін є ендогенною ендоканабіноїдоподібною сполукою. Його концентрації значно збільшуються при трьох різних запальних і нейропатичних станах. Підвищені рівні можуть бути пов’язані із захисною місцевою протизапальною та знеболюючою дією. Було показано, що CBD має потужний протизапальний та антиоксидантний ефект. Генерація супероксиду мітохондрій, індукована високим вмістом глюкози, активація NF-kappaB, утворення нітротирозину, експресія iNOS і молекул адгезії ICAM-1 і VCAM-1, моноцитно-ендотеліальна адгезія, трансендотеліальна міграція моноцитів і порушення функції ендотелію людини з баріроном ендотеліальні клітини (HCAEC) були ослаблені попередньою обробкою CBD.
У експериментах із щурами з ожирінням і худими було виявлено, що римонабант є потужним інгібітором сенсорної гіперчутливості, пов’язаної з артритом, спричиненим CFA у щурів з ожирінням, у яких запальна реакція є більш серйозною, ніж у худих щурів. Таким чином, він може мати терапевтичний потенціал при запальних захворюваннях, пов’язаних з ожирінням.
Хвороба Паркінсона, хвороба Хантінгтона, синдром Туретта, хвороба Альцгеймера, епілепсія
Хвороба Паркінсона (ХП) є хронічним прогресуючим нейродегенеративним розладом. Основною патологічною ознакою ХП є дегенерація дофаміновмісних (ДВ) нейронів чорної речовини, що призводить до вираженої ДВергічної денервації смугастого тіла. Необоротна втрата ДВ-опосередкованого контролю над смугастою функцією призводить до типових моторних симптомів, що спостерігаються при ХП, тобто брадикінезії, тремору та ригідності. Було припущено, що канабіноїди можуть мати певні сприятливі ефекти при лікуванні PD. У експериментах на тваринах канабіноїди забезпечують нейропротекцію проти токсичності 6-гідроксидопаміну in vivo та in vitro.
У більшості пацієнтів з ХП, які проходять терапію леводопою, протягом 10 років лікування розвиваються рухові ускладнення (дискінезії), що призводять до інвалідності. Нещодавні дослідження на тваринних моделях і в клініці показують, що антагоністи рецепторів CB1 можуть виявитися корисними для лікування симптомів паркінсонізму і дискінезії, спричиненої леводопою, тоді як агоністи рецепторів CB1 можуть мати значення для зменшення дискінезії, спричиненої леводопою. У моделі щурів, які отримували резерпін ХП агоніст рецептора дофаміну D2 квінпірол викликав значне полегшення акінезії. Цей ефект був значно зменшений при спільній ін’єкції з агоністом канабіноїдних рецепторів WIN 55,212-2. Одночасне введення антагоніста CB1 римонабанту з квінпіролом і WIN 55,212-2 блокувало вплив WIN 55,212-2 на спричинене квінпіролом полегшення акінезії. У експериментах на тваринах хронічний леводопа все більш виражені мимовільні рухи ротової порожнини які були ослаблені WIN 55,212-2. -2. Цей ефект також був знищений римонабантом. В інших дослідженнях було виявлено, що римонабант надає певний сприятливий вплив на пригнічення рухів, характерне для ХП, принаймні в деяких дозах. Ін’єкція 0,1 мг/кг римонабанту частково послабила гіпокінезію, проявлену тваринами з ХП, без ефектів у контрольних щурів, тоді як більш високі дози (0,5-1,0 мг/кг) були неефективними. Нігростриатальне ураження MPTP пов’язане зі збільшенням у рецепторах CB1 в базальних гангліях у людей та приматів, які не є людьми; це збільшення можна було б скасувати за допомогою тривалої терапії леводопою, що свідчить про те, що блокада рецепторів CB1 може бути корисною як допоміжний засіб длялікування моторних симптомів паркінсонізму. Високі рівні ендогенних канабіноїдів виявлені в спинномозковій рідині пацієнтів, які не отримували лікування. Застосування інгібіторів розпаду ендоканабіноїдів зменшило паркінсонічний моторний дефіцит in vivo. Таким чином, як агоністи, так і антагоністи CB-рецепторів, схоже, допомагають при деяких симптомах паркінсонізму. У клінічних дослідженнях агоніст канабіноїдних рецепторів набілон значно знижував дискінезію, спричинену леводопадом при ХП. THC покращив руховий контроль у пацієнта музиканта з дистонією. На відміну від цих висновків, деякі дослідження не виявили впливу канабіноїдів на ХП: орально введений екстракт канабісу показав відсутність об’єктивного чи суб’єктивного покращення дискінезій чи паркінсонізму, відсутність значного зменшення дистонії після лікування набілоном, і римонабант теж не зміг покращити рухову інвалідність при паркінсонії. Однак анонімна анкета, надіслана всім пацієнтам, які відвідують Празький центр рухових розладів, показала, що 25 % респондентів вживали канабіс, і 45,9 % з них описували певну користь. Таким чином, канабіноїди, здається, здатні лікувати принаймні деякі симптоми неврологічних захворювань.
Хвороба Гантінгтона (ХГ) або хорея Гантінгтона («хорея» означає «танець» грецькою) — це розлад, що характеризується характерним хоретичним рухом, прогресуючими руховими порушеннями, деменцією та іншими когнітивними порушеннями. Невропатологічно ХГ характеризується дегенерацією середніх колючих смугасто-еферентних γ-аміномасляної кислоти (ГАМК)ергічних нейронів та атрофією хвостатого ядра. Поглиблені ступені ХГ показали майже повну втрату рецепторів CB1 і подальше виснаження рецепторів Dl у хвостатому ядрі, скорлупі та бліді кулі, а також збільшення зв’язування з рецепторами GABAA у блідій кулі внутрішньої кулі. Втрата канабіноїдних рецепторів при ХГ також спостерігається в чорній субстанції. Ці результати свідчать про можливу терапевтичну роль агоністів канабіноїдів при ХГ. Справді, арваніл, гібридний ендоканабіноїд і ванілоїдне з’єднання, поводиться як антигіперкінетичний агент у щурячої моделі ХГ, утвореної двостороннім внутрішньостриарним застосуванням 3-нітропропіонової кислоти (3-NP). Зменшення підвищеної рухливості, що спостерігається внаслідок ураження 3NP у щурів у відкритому тесті, викликаному AM404 (інгібітором транспорту анандаміду, який також зв’язується з ванілоїдним рецептором, було змінено, коли тварин попередньо обробляли капсазепіном (антагоніст VR1), але не SR141716A, що свідчить про головну роль VR1 рецепторів в антигіперкінетичних ефектах AM404. Проте і капсаїцин (агоніст VR1), і CP55,940 (агоніст CB1) мали антигіперкінетичну активність Хінолінова кислота (QA) є екситотоксином, який при введенні в смугасте тіло щурів відтворює багато ознак ХГ, стимулюючи відтік глутамату. Перфузія за допомогою WIN 55,212-2 значно та дозозалежно запобігала збільшенню позаклітинного глутамату, індукованого QA. Таким чином, стимуляція рецепторів CB1 може призвести до нейропротекторних ефектів проти ексайтотоксичної смугастої токсичності. У клінічному дослідженні CBD не був ані симптоматично ефективним, ані токсичним у пацієнтів з ХГ без нейролептиків.
Синдром Туретта (СТ) — це складне спадкове захворювання невідомої етіології, що характеризується множинними руховими та голосовими тиками. Анекдотичні повідомлення свідчать про те, що вживання канабісу може покращити тики та поведінкові проблеми у пацієнтів із СТ. Дійсно, ТГК зменшував тики у пацієнтів із СТ, не викликаючи гострих та/або довготривалих когнітивних дефіцитів. В іншому клінічному дослідженні, де тяжкість тиків оцінювали за допомогою шкали самооцінки та оцінок експертів, пацієнти також оцінювали тяжкість асоційованого розладу поведінки. Після лікування ТГК спостерігалося значне покращення моторних і голосових тиків та нав’язливих станів. Існувала значна кореляція між поліпшенням тику і максимальною концентрацією 11-OH-THC у плазмі, що свідчить про можливу роль цього метаболіту THC у позитивному ефекті THC. В іншому, більш тривалому клінічному дослідженні, THC також був визнаний ефективним і безпечним при лікуванні тиків. З огляду на позитивний ефект агоністів CB1 при лікуванні СТ, досліджували мутації гена CB1. Однак не було виявлено, що СТ викликаний мутаціями в гені CNR1.
Бічний аміотрофічний склероз (БАС) є фатальним нейродегенеративним розладом, що характеризується вибірковою втратою моторних нейронів у спинному мозку, стовбурі головного мозку та моторній корі. Багато ефектів марихуани можуть бути застосовні до лікування БАС. Вони включають знеболювання, розслаблення м’язів, розширення бронхів, зменшення слини, стимуляцію апетиту та індукції сну. Крім того, його сильні антиоксидантні та нейропротекторні ефекти можуть продовжити виживання нейронних клітин. Справді, лікування постсимптоматичних 90-денних мишей SOD1G93A (модель БАС) за допомогою WIN 55,212-2 значно сповільнювало прогресування захворювання. Крім того, генетична абляція ферменту FAAH, що призводить до підвищення рівня ендоканабіноїдного анандаміду, запобігла появі ознак захворювання у цих мишей. Дивно, але підвищення рівня канабіноїдів за допомогою абляції WIN 55,212-2 або FAAH не вплинуло на тривалість життя. Абляція рецептора CB1, навпаки, не вплинула на початок захворювання у цих мишей, але значно подовжила тривалість життя. Разом ці результати показують, що канабіноїди мають значний нейропротекторний ефект у цій моделі БАС, і припускають, що ці корисні ефекти можуть бути опосередкованими механізмами, які не є рецепторами CB1. Було також встановлено, що THC затримує прогресування захворювання. Лікування AM1241, CB2- селективний агоніст, був ефективним для уповільнення ознак прогресування захворювання, коли його вводили після появи ознак на мишачій моделі БАС. Введення на початку тремтіння сповільнювало рухові порушення у мишей, які отримували лікування, порівняно з контрольними засобами; крім того, AM-1241 подовжував виживання у цих мишей. В опитуванні серед пацієнтів з БАС конопля була помірно ефективною у зменшенні симптомів втрати апетиту, депресії, болю, спастичності та слинотечі. Було також запропоновано, що канабіноїди мають роль у лікуванні хвороби Альцгеймера (ХА). THC конкурентно інгібує ацетилхолінестеразу (AChE) та запобігає агрегації амілоїдних бета-пептидів (Abeta), спричиненої AChE, ключового патологічного маркера AD. Лікування THC також зменшувало тяжкість порушеної поведінки, і цей ефект зберігався протягом періоду плацебо у пацієнтів, які мали отримати THC. Порівняно з вихідним рівнем, THC призвів до зниження нічної рухової активності. Ці результати були підтверджені покращенням загальної оцінки Neuropsychiatrie Inventory, а також підбалами збудження, аберантної моторики та нічної поведінки; побічних ефектів не спостерігалося.
Дослідження протисудомної активності канабіноїдів почалися в 1975 році, коли було показано що CBD і чотири похідні CBD (CBD-альдегід-діацетат, 6-оксо-CBD-діацетат, 6-гідрокси-CBD-три-ацетат і 9-гідрокси-CBD-триацетат) вони захищають від максимальних електрошокових судом у мишей, потенціюють час сну пентобарбіталом і зменшують спонтанну рухову активність. Пізнішебуло показано, що додаткові аналоги CBD, активні CBD, було виявлено ефективним протисудомним засобом зі специфічністю, більш порівнянною з лікарськими засобами клінічно ефективними при великих, але не при незначних судомах. Крім того, виявляється, що КБД посилює протисудомну дію ліків при великих судомах і зменшує їх дію при невеликих судомах. Отже, КБД був запропонований як препарат для лікування дітей з фармакорезистентною епілепсією. Застосування антагоністів рецепторів CB16 SR14171 або AM251 до «епілептичних» нейронів викликав розвиток безперервної епілептиформної активності, що нагадує електрографічний епілептичний статус. Індукція активності, подібної до епілептичного статусу, антагоністами рецепторів CB1 була оборотною і її можна було подолати за допомогою максимальних концентрацій агоністів CB1. Арахідоніл-2′-хлоретіламід (ACEA), високоселективний агоніст канабіноїдного рецептора CB1, посилює протисудомну дію валпроу у моделі нападів, викликаних максимальним електрошоком у миші. На даний момент недостатньо даних, щоб визначити, чи впливає випадкове чи хронічне вживання марихуани на частоту нападів. В одному звіті про випадок було запропоновано куріння марихуани щоб викликати судоми. В іншому дослідженні пацієнти, які страждають від вторинної генералізованої епілепсії з скроневим фокусом, яку лікували CBD, залишалися майже без судомних криз протягом усього експерименту; інші пацієнти продемонстрували часткове покращення клінічного стану.
Біполярний розлад, шизофренія, посттравматичний стресовий розлад (ПТСР), депресія, тривога, безсоння
Вживання канабісу є звичайним явищем у пацієнтів з біполярним розладом, і неочевидні повідомлення свідчать про те, що деякі пацієнти вживають марихуану для полегшення симптомів як манії, так і депресії. У звіті про випадок одна пацієнтка виявила, що канабіс приборкав її маніакальну лють; інші описували використання канабісу як доповнення до літію (що дозволяє зменшити споживання) або для полегшення побічних ефектів літію.
Вплив канабіноїдів на шизофренію є суперечливим. Нейропсихологічні результати у здорових добровольців, інтоксикованих ТГК, демонструють значну схожість з даними, отриманими від пацієнтів, які страждають продуктивними шизофренічними психозами, щодо порушень внутрішньої регуляції процесів сприйняття. У недавньому дослідженні було виявлено, що рівень анандаміду підвищується у пацієнтів з першим епізодом шизофренії , і що ТГК пригнічує передачу анандаміду. Це спостереження, можливо, означає, що ТГК знижує ендогенне вироблення анандаміду, який насправді може бути захисним механізмом – імовірно, можна порівняти з відомим спостереженням, що введення кортикостероїдів блокує синтез кортикостероїдів. Дані експериментально-психологічних тестів показують, що зміни особистості, викликані прогресуванням шизофренії, можна порівняти з психопатологічним явищем через інтоксикацію канабісу. В іншому дослідженні психоз, який розвивається або повторюється в контексті вживання канабісу, не мав характерної психопатології чи форми. Пацієнти з першим епізодом шизофренії, які тривалий час вживали каннабіс, були значно молодшими на початку захворювання, переважно чоловіки, і частіше страждали на параноїдну шизофренію (з кращим прогнозом), ніж ті, хто не вживав коноплю. Однак тенденція до більшості проникливості та меншості образливих або звинувачувальних галюцинацій було помічено серед споживачів канабісу. Це заперечує особливий психоз, подібний до шизофренії, спричинений канабісом. У пацієнтів із шизофренією та зловживанням канабісом було виявлено менше аволії та менше симптомів апатії, ніж у тих, хто не зловживав. В іншому клінічному дослідженні роль рецепторів CB1 у шизофренії була досліджена шляхом введення пацієнтам антагоніста CB1. Група, яка отримувала антагоніст CB1, не відрізнялася від групи, яка отримувала плацебо за жодним показником.
CBD викликає антипсихотичний ефект. Було встановлено, що він є безпечним і добре переносимим альтернативним засобом лікуванням шизофренії. (Див., однак, також це посилання).
Посттравматичний стресовий розлад (ПТСР) – це термін для важких психологічних наслідків впливу стресових, високотравматичних подій або протистояння з ними. Вважається, що канабіноїди допомагають у таких випадках. Тварини, які отримували AM404, продемонстрували зменшене відновлення страху, викликаного шоком. У експериментах з умовним страхом і водним лабіринтом Морріса миші FAAH (-/-), які отримували інгібітор FAAH OL-135, не виявляли жодних порушень пам’яті або рухових порушень, але показали значне збільшення швидкості вимирання. SRI 41716 блокував дію OL-135, що свідчить про те, що ендогенний анандамід відіграє роль фасилітатора в зникненні через механізм дії рецептора CB1. Навпаки, THC не вплинув на швидкість вимирання, що свідчить про те, що FAAH є більш ефективною мішенню, що сприяє вимиранню, ніж агоніст рецептора CB1 прямої дії. Однак при повторному стресі або гострому сильному стресі дефіцит рецептора CB1 викликає стійке поведінкове пригнічення. Здавалося, що повторний стрес викликав кумулятивний страх у мишей з враженням рецептора CB1. У звітах про вживання психоактивних речовин серед ветеранів, які звертаються за допомогою, діагностика ПТСР була значною мірою пов’язана з вживанням марихуани. Ці спостереження припускають, що ендоканабіноїдну систему можна модулювати покращуючи емоційне навчання, і що ендоканабіноїдні модулятори можуть бути терапевтично корисними як допоміжні психотерапевтичні засоби, що ґрунтуються на впливі, наприклад ті, що використовуються для лікування посттравматичного стресу та інших тривожних розладів. Відомо, що поліморфізм гена рецептора CB1 змінює транскрипцію гена. У пацієнтів з хворобою Паркінсона наявність двох довгих алелей з більш ніж 16 повторюваними тринуклеотидами AAT в гені CNR1 асоціювалася зі зниженою поширеністю депресії.
Було виявлено, що CBD та деякі похідні викликають селективний анксіолітичний ефект у підвищеному плюс-лабіринті в обмеженому діапазоні доз. Одноразова доза набілону спричиняла лише легке покращення тривожності; при лікуванні повторними дозами було відзначено різке покращення що до тривожності в групі набілону.
Вплив марихуани на режим сну людини було помічено давно. Було помічено зниження щільності рухів очей, з певною толерантністю до цього ефекту. THC є заспокійливим, тоді як CBD має тривожні властивості, оскільки він підвищує активність неспання та протидіє залишковій седативній активності THC.
Астма, серцево-судинні розлади, глаукома
Астма – це хронічне захворювання дихальної системи, при якому дихальні шляхи час від часу звужуються, запалюються і вистелені надмірною кількістю слизу. У експериментах на тваринах після бронхоспазму, викликаного метахоліном або фізичним навантаженням, марихуана викликала швидке поліпшення бронхоспазму та пов’язаної з ним гіперінфляції. У людей звичне куріння марихуани може викликати легке, але значне функціональне порушення легень; Однак для ТГК було виявлено помірну і непостійну бронходилатаційну дію. В інших клінічних дослідженнях було виявлено, що куріння марихуани або вживання ТГК збільшують провідність дихальних шляхів. Інші рослинні канабіноїди не забезпечують ефективного розширення бронхів. Щоденне вживання ТГК не було пов’язано з клінічною переносимістю. ТГК, який вводили в дозованих об’ємах шляхом інгаляції з аерозольного пристрою пацієнтам, які перебувають у рівноважному стані, збільшеною піковою швидкістю видиху (PEFR) та об’ємом форсованого видиху за 1 секунду (ОФВ1) і викликав бронходилатацію. В іншому дослідженні сальбутамол і ТГК значно покращили вентиляційну функцію. Максимальне розширення бронхів досягалося швидше при застосуванні сальбутамолу, але через 1 годину обидва препарати були однаково ефективними. Серцево-судинних порушень або порушень настрою не було виявлено, а загальні канабіноїди в плазмі через 15 хвилин не були виявлені радіоімунним аналізом. Механізм дії ТГК відрізнявся від дії симпатоміметичних препаратів.
В іншому дослідженні ТГК викликав прихильну стимуляцію та парасимпатичне пригнічення шляхів контролю серцево-судинної системи. Пікове підвищення частоти серцевих скорочень після ТГК було ослаблено атропіном і пропранололом і майже знищено попереднім лікуванням атропіном-пропранололом. Гострий ТГК значно збільшував частоту серцевих скорочень, скорочував період передвиштовхування (PEP) і подовжував час викиду лівого шлуночка (LVETc) без будь-яких змін післянавантаження; це покращило роботу серця. Часткове пригнічення цього ефекту було досягнуто за допомогою попередньої (β-адренергічної блокади.) Натомість, після викурювання однієї-трьох сигарет марихуани частота серцевих скорочень, серцевий викид, ударний об’єм, фракція викиду, PEP і LVET не змінювалися. Таким чином, у довготривалих інтенсивних споживачів канабісу марихуана не має значного впливу на скоротливість міокарда незалежно від її впливу на частоту серцевих скорочень. Серцево-судинні ефекти гострого введення ТГК включали підвищення симпатичного та зниженого парасимпатичного тонусу; тахікардію лежачи та підвищення артеріального тиску з спостерігалися вертикальна гіпотензія. При повторному введенні лежачи спостерігалися брадикардія і зниження артеріального тиску з толерантністю до ортостатичної гіпотензії. Римонабант послаблював гіпотензивний ефект викуреної марихуани у чоловіків-курців, що свідчить про роль рецептора CB1 в гіпотензивній дії канабіноїдів.
Ряд досліджень показують, що існує корелятивний, але не обов’язково причинний зв’язок між глаукомою та системною гіпертензією. До очної гіпертензії (ОГТ) відноситься будь-які ситуації, коли внутрішньоочний тиск вище норми, і є найважливішим фактором ризику розвитку глаукоми. ТГК, CBN і набілон були активними у зниженні внутрішньоочного тиску (ВОТ) у кроликів, тоді як CBD – ні. Деякі похідні ТГК були більш активними щодо зниження ВОТ, ніж вихідний канабіноїд; деякі місцево використовувані м’які аналоги, які не мають системних ефектів, також були активними при зниженні ВОТ. Вплив 2-AG на ВОТ був двофазним (тобто початкове підвищення ВОТ з наступним зниженням). Навпаки, ефір ноладину знижував ВОТ відразу після місцевого застосування, і початкового підвищення ВОТ не спостерігалося. AM251 блокував вплив на ВОТ ефіру ноладину, але не впливав на дію 2-AG. Місцеве застосування анандаміду та арахідонілпропіонітрилеаміду знижувало ВОТ; римонабант протидіяв зниженню ВОТ, що свідчить про те, що канабіноїди знижують ВОТ через рецептори CB1. Важливо, що в циліарному тілі виявлено вищі рівні мРНК CB1, ніж у райдужній оболонці, сітківці та судинній оболонці. мРНК CB2 не виявлялася. Ця модель експресії підтримує специфічну роль рецептора CB1 у контролі ВОТ. При місцевому введенні в котячі очі за допомогою осмотичних міні-насосів екстракту цільної марихуани, ТГК та інші рослинні канабіноїди знижували ВОТ, тоді як канабіхромен був неактивним. Після лікування ТГК спостерігалася очна токсичність, яка складалася з еритеми кон’юнктивиту та хемозу, а також помутніння рогівки. Хоча ці зміни також відбулися з екстрактом марихуани, їх інтенсивність значно зменшилася. Навпаки, ніякої токсичності для очей не було виявлено під час введення рослинних канабіноїдів, крім THC. Ще в 1971 році було показано, що куріння марихуани знижує ВОТ ; згодом цей ефект був підтверджений. Піковий вплив ТГК на центральну нервову систему добре збігався зі зниженням внутрішньоочного тиску, викликаним препаратом; Проте під час гіпотонії відчувалася ейфорія. Результати вказують на те, що ТГК може мати цінність як гіпотонізуючий очний препарат. Функціональні реакції після інгаляції ТГК у сидячих пацієнтів з нормальним і гіпертонічною хворобою включали незмінне збільшення частоти серцевих скорочень з наступним значним зниженням систолічного тиску, діастолічного тиску та внутрішньоочного тиску. Інтенсивність та тривалість реакцій артеріального та очного тиску на ТГК були більшими у гіпертоніків, ніж у пацієнтів з нормальним тиском; зміни очного тиску були паралельними змінам артеріального тиску у пацієнтів з глаукомою. Одноразова сублінгвальна доза ТГК, але не канабідіол, тимчасово знижувала ВОТ і добре переносилася більшістю пацієнтів.
Рак
Антипроліферативна дія канабіноїдів на ракові клітини вперше була помічена в 1970-х роках. Відтоді було виявлено, що канабіноїди діють на різні лінії ракових клітин за допомогою різних механізмів. Також було виявлено, що канабіноїди є супресорами ангіогенезу та інвазії пухлин. Наші знання про протипухлинну активність канабіноїдів швидко розширюються; тому тут представлені лише результати останніх досліджень на цю тему. Агоністи канабіноїдів HU-210 і JWH-133 сприяли гліальної диференціації залежно від рецепторів CB. Більше того, канабіноїдний виклик знизив ефективність стовбурових клітин гліоми ініціювавши утворення гліоми in vivo. Непсихоактивний канабідіолініціював активацію каспаз і окислювальний стрес у клітинах гліоми людини. Меланоми людини експресують рецептори канабіноїдів CB1 і CB2. Активація цих рецепторів зменшувала ріст, проліферацію, ангіогенез і метастазування, а також посилювала апоптоз меланом у мишей. ТГК через активацію рецепторів канабіноїдів CB2 зменшував проліферацію клітин раку молочної залози людини, блокуючи прогресування клітинного циклу та індукуючи апоптоз. ТГК затримав клітини в G2M через зниження регуляції Cdc2. Канабіноїди індукували апоптоз пухлинних клітин підшлункової залози через стресовий білок p8 і гени, пов’язані зі стресом ендоплазматичної мережі. Ці ефекти були попереджені блокуванням канабіноїдного рецептора CB2 або фармакологічним пригніченням синтезу церамідів de novo. Було виявлено, що апоптоз, індукований THC в Т-клітинах лейкемії Jurkat, регулюється транслокацією Bad в мітохондрії. Вплив клітин лейкемії CBD призвели до опосередкованого CB2 зниження життєздатності клітин та індукції апоптозу (хоча вважається, що CBD не зв’язується ні з рецепторами CB1, ні з CB2). Варто відзначити, що вплив CBD призвів до збільшення виробництва активних форм кисню (ROS), а також до збільшення експресії NAD(P)H оксидаз Nox4 і p22(phox). Канабіноїдний апоптоз раку простати людини клітини LNCaP пройшли через тривалу активацію ERK1/2, що призвело до зупинки клітинного циклу Gl. Римонабант пригнічував проліферацію клітин раку молочної залози людини за допомогою механізму, опосередкованого ліпідним рафтом. У пілотному дослідженні фази I дев’ять пацієнтів із рецидивуючою мультиформною гліобластомою, які мали раніше невдалу стандартна терапію (операція та променева терапія) і мали чіткі ознаки прогресування пухлини, вводили ТГК внутрішньопухлинно. THC інгібував проліферацію пухлинних клітин in vitro, зменшував імунне фарбування пухлинних клітин Ki67 і подовжував час виживання двох пацієнтів.
Висновок
Багато наркотичних речовин, які використовуються сьогодні, можуть викликати звикання та призводять до зловживання ними,наприклад, опіати, кокаїн, бензодіазепіни, барбітурати, холінергічні агоністи, кетамін, дофамінергічні агоністи, амфетаміни та інші. Тим не менш, вони все ще є важливою частиною нашої фармакопеї. Марихуана століттями використовувалася як лікарська рослина, але протягом минулого століття через її зловживання та звикання вона була вилучена з клінічної практики. Тепер ми вважаємо, що її складові та споріднені сполуки мають бути повернуті до клінічного використання. Причини: (I) терапевтичний потенціал агоністів CB1 величезний, як описано в цьому огляді; (II) для місцевої дії можна використовувати місцеві агоністи CB1 або агоністи, які не проникають крізь гематоенцефалічний бар’єр; (III) канабіноїди, що діють специфічно на рецептори CB2, які не викликають психоактивності, можуть бути використані переферично проти багатьох захворювань (таких як остеопороз, який є лише одним із багатьох прикладів); (IV) є додаткові, нові канабіноїдні цілі, відмінні від рецепторів CB1/CB2, які не викликають психоактивності; (V) є канабіноїди, такі як CBD, які не викликають психоактивності, але мають різноманітні терапевтичні ефекти.