Оглавление
Каннабис (Cannabis sativa, или конопля) и его составляющие, в частности каннабиноиды, были в центре обширных химических и биологических исследований в течение почти полувека с момента открытия химической структуры его основного активного компонента, Δ9—тетрагидроканнабинола (Δ9—ТГК). Поведенческие и психотропные эффекты растения объясняются содержанием в нем соединений этого класса, каннабиноидов, в первую очередь Δ9-ТГК, который вырабатывается в основном в листьях и цветочных бутонах растения. Кроме Δ9-ТГК, существуют также непсихоактивные каннабиноиды с несколькими лекарственными функциями, такими как каннабидиол (CBD), каннабихромен (CBC) и каннабигерол (CBG), наряду с другими неканнабиноидными компонентами, принадлежащими к различным классам натуральных продуктов. На сегодняшний день в каннабисе выявлено более 560 составляющих. Недавние открытия лекарственных свойств каннабиса и каннабиноидов в дополнение к их потенциальному применению в лечении ряда серьезных заболеваний, таких как глаукома, депрессия, невралгия, рассеянный склероз, болезнь Альцгеймера и облегчение симптомов ВИЧ/СПИДа и рака, придали импульс поискам дальнейшего понимания химии, биологии и лекарственных свойств этого растения.
В этом материале представлен обзор ботаники, аспектов выращивания и фитохимии каннабиса и его химических компонентов. Особое внимание уделяется недавно идентифицированным/изолированным соединениям. Кроме того, также рассматриваются методы выделения компонентов каннабиса и аналитические методы, используемые для качественного и количественного анализа каннабиса и его продуктов.
Введение
Cannabis sativa L. (Cannabaceae) встречается в различных местах обитания и на высотах, начиная от уровня моря и заканчивая альпийскими предгорьями Гималаев, откуда он, возможно, произошел [1]. Выращиванию и использованию каннабиса от 5000 до 6000 лет, что затрудняет точное определение происхождения этого вида [2]. Кроме того, это один из старейших растительных источников пищевых и текстильных волокон [3]. Выращивание C. sativa ибо текстильное волокно произошло из Египта и Западной Азии и впоследствии было завезено в Европу между 1000 и 2000 годами до н. э. и в Южную Америку (Чили) в 1545 году. Более 60 лет спустя (1606) культивирование конопли было введено в Северной Америке (Порт-Ройял, Канада) [4]. Действующие федеральные законы в Соединенных Штатах запрещают выращивание C. sativa, в том числе конопли.
Каннабис сатива имеет богатую историю лекарственного применения, уходящую корнями в древние времена. Первые сведения о его медицинском применении пришли с Ближнего Востока и Азии в шестом веке до н. э. Его внедрение в западную медицину произошло гораздо позже, в начале девятнадцатого века [5, 6]. Этот вид был показан при лечении боли, глаукомы, тошноты, депрессии и невралгии [7, 8, 9, 10, 11]. Терапевтическая ценность фитоканнабиноидов также использовалась для лечения симптомов ВИЧ/СПИДа и лечения рассеянного склероза [12, 13].
Номенклатура
Ботаническая номенклатура
Таксономическая классификация сативы каннабиса приведена ниже:
Царство: Plantae (растения)
Подчиненность: Трахеобионты (сосудистые растения)
Супердивизион: Сперматофиты (семенные растения)
Деление: Магнолиофита (цветущие растения)
Класс: Магнолиопсида (двудольные)
Подкласс: Hamamelididae
Заказ: Крапивница
Семья: Каннабисные
Род: Конопля
Вид: сатива
Аббревиатура таксономического органа: L.
Количество видов в роде Каннабис было предметом долгих дебатов. Систематики по-разному охарактеризовали род “Каннабис”, основываясь на его политипичной природе [14, 15, 16]. Шульц и др. разделили этот род на три отдельных вида: Cannabis sativa, Cannabis indica и Cannabis ruderalis [17]. В отличие от этого, несколько других исследователей считали, что род имеет два основных вида: C. sativa и C. indica [18, 19]. Однако, несмотря на эти различные таксономические интерпретации, каннабис обычно рассматривается как представляющий собой только один, весьма разнообразный вид, C. sativa L. [20, 21, 22, 23]. C. sativa, C. indica и C. ruderalis в настоящее время признаны разновидностями C. sativa L. (вар. сатива, вар. индика и вар. рудералис, соответственно). Сорта сатива и индика являются более экономически важными и широко распространенными, в то время как рудералис считается более выносливым сортом, выращиваемым в северных Гималаях и южных штатах бывшего Советского Союза, который характеризуется редким ростом “сорняков” и редко культивируется из-за содержания в нем лекарств. По сравнению с сативой, для которой средняя высота растений колеблется от 2,5 до 3,5 м, растения индики сорт, как правило, короче (средняя высота около 1,8 м) и более пышный, с более широкими и темно-зелеными листьями, которые рано созревают при выращивании на открытом воздухе.

Распространенные названия
Во всем мире местное население называет каннабис сатива многими распространенными названиями, некоторые из которых кратко изложены ниже.
Арабский: Аль-Бханго; Аль-Гашиш; Аль-Канаап
Китайский: Сиань ма; е ма
Датский: Конопля
Голландский: Хеннеп
Английский: конопля; марихуана
Финский: Hamppu
Французский: Chanvre; chanvre d’Inde; chanvre indien; chanvrier; chanvrier
Немецкий: Hanf; Haschisch; indischer Hanf
Индианки: Бханг; чарас; гянджа
Японский: Машинин
Непальский: Cares; gajiimaa; gaanjaa
Португальский: Cânhamo; maconha
Русский: Каннабис сатива
Испанский: Cáñamo; grifa; hachís; mariguana; marijuana
Шведский: Порканча
Конопля сатива обычно является двудомным видом, то есть мужские и женские цветки развиваются на отдельных растениях. Пол определяется по гетероморфным хромосомам, причем самцы гетерогаметичны (XY), а самки гомогаметичны (XX). Морфологически трудно идентифицировать мужские и женские растения на вегетативной стадии. При половом диморфизме, возникающем на поздних стадиях развития растений, мужские растения можно отличить от женских растений после начала цветения. Молекулярные методы теперь могут быть использованы для дифференциации мужских и женских растений на ранней стадии [24, 25, 26, 27, 28, 29]. Половой фенотип каннабиса иногда проявляет гибкость, приводящую к образованию гермафродитных цветков или обоеполых соцветий, т. е. денежного фенотипа.
Определение каннабиса
Согласно Кодексу Соединенных Штатов (USC), термин “марихуана/каннабис” определяется как “все части растения C. sativa L., независимо от того, растут они или нет; их семена; смола, извлеченная из любой части растения; и каждое соединение, процесс производства, соль, производные, смесь или препараты растения, его семена или смола. Такое определение не включает зрелых стеблей, волокна, произведенные из стеблей, масло или пищевые блюда, приготовленные из семян, любое другое соединение, соли, производные и смеси,стебли (кроме смол, выделенных из них), волокна, масла, жмых, или стерилизованные семена, которые не способны к прорастанию” [30].
“Каннабис” — это лекарственный препарат, приготовляемый из двудольного (растения с прорастающими листьями), травянистого (без древесные, надземные части которых отмирают после плодоношения), двудомного (мужские особи отличаются от женских), апетального (цветок имеет венчик), однолетнего травянистого растения, С. Sativa L. и его разновидностей (семейство: Cannabaceae), которые биосинтезируют терпенофенольные каннабиноиды или фитоканнабиноиды, накапливающиеся преимущественно в железистых трихомах растения.
Выращивание каннабиса сативы
Каннабис сатива-это однолетняя культура, которую можно успешно выращивать как в помещении, так и на открытом воздухе, причем каждая из них имеет свои преимущества и недостатки. В то время как при выращивании в помещении можно регулировать фотопериод, чтобы вызвать цветение и созревание (возможно три-четыре урожая в год), выращивание в условиях открытого грунта обычно ограничивается одним урожаем в год (требуется от пяти до семи месяцев в зависимости от сорта).
Выращивание на открытом воздухе
Выращивание нового урожая из семян обычно начинается в конце марта-начале апреля. Сбор урожая обычно длится до ноября-начала декабря в северном полушарии, но это зависит от сорта. Семена высевают в небольшие биоразлагаемые горшки, а затем отобранные здоровые саженцы пересаживают в поле. В качестве альтернативы семена могут быть посажены непосредственно в поле. Мужские цветки, а затем женские цветки появляются в течение двух-трех месяцев (середина июля) после посева/пересадки. Как правило, отбраковывают мужские растения, так как мужские растения содержат меньше Δ9-тетрагидроканнабинола (Δ9-THC) по сравнению с женскими растениями, и это также позволяет избежать перекрестного опыления как среди разных сортов, так и внутри одного и того же сорта.
Хотя растения, выращиваемые на открытом воздухе, имеют больше биомассы по сравнению с растениями, выращенными в помещении, в зависимости от погоды и предоставленного пространства, трудно поддерживать постоянный химический профиль в условиях улицы, если они выращены из семян, из-за аллогамной природы C. sativa (перекрестное оплодотворение). Поэтому вегетативное размножение черенками является подходящим методом для поддержания однородности химических профилей производимых культур.
Выращивание в помещении
Выращивание сативы каннабиса в помещении в контролируемых условиях окружающей среды позволяет полностью контролировать жизненный цикл растения, что приводит к управлению качеством и количеством биомассы. Это важно при производстве C. sativa с определенным химическим профилем для фармацевтического применения. Параметры окружающей среды, такие как уровень освещенности, фотопериод, влажность, температура, концентрация CO2 и циркуляция воздуха, играют решающую роль в производстве этой установки внутри помещений.
Конопля сатива требует высокой плотности потока фотосинтетических фотонов (PPFD) для фотосинтеза и роста [31]. Собственные исследования, проведенные настоящими авторами, показали, что C. sativa может использовать довольно высокий уровень PPFD и температуру для процессов обмена газом и водяным паром и может работать намного лучше, если выращивать при температуре около 1500 мкмоль м-2 с−1 PPFD (сопоставимый с солнечным летним днем в северной части Миссисипи) и температурой около 25-30°C. Для размножения в помещении могут использоваться различные источники света, а именно люминесцентные лампы для молодых черенков и металлогалогенные (MH) и/или натриевые лампы высокого давления (HPS) для взрослых растений. Для регулирования ламп MH и HPS требуются отдельные балласты. Луковицы MH и HPS должны находиться на расстоянии 0,9–1,2 м от растений, чтобы избежать чрезмерного воздействия. Однако при использовании луковиц для выращивания в помещении трудно достичь уровней фотосинтетически активного излучения (PAR) до 1500 мкмоль м−2 с−1 PPFD. Кроме того, фотопериоды играют важную роль в регулировании вегетативного и цветущего роста C. sativa. Эти растения поддерживают стадию вегетативного роста при условии, что поддерживается цикл фотопериода, состоящий из >18 ч света и ≤6 ч темноты. 12-часовой фотопериод вызывает цветение C. sativa [31].
В помещении для выращивания уровень влажности имеет решающее значение для всех стадий роста растений, начиная от прорастания семян или вегетативного размножения до распускания почек и сбора урожая. Молодые растения требуют высокой влажности по сравнению с хорошо развитыми растениями. Вегетативные черенки требуют регулярного распыления воды на листья для поддержания высокой влажности (около 70-75%) в своем микроклимате до тех пор, пока растения не укоренятся, в то время как активные стадии вегетации и цветения требуют влажности 55-60%. Количество и частота полива для C. sativa зависит от множества факторов, таких как стадия роста, размер растений и горшков, температура, влажность и другие параметры. На ранней стадии рассады или вегетации рекомендуется поддерживать почву влажной; однако верхний слой почвы должен быть сухим до полива укоренившихся растений.
Циркуляция воздуха является еще одним важным аспектом среды выращивания в помещении. Регулирование газо-и парообмена между листьями и микроокружением достигается за счет воздушного потока вокруг поверхностей листьев. Это влияет на теплопроводность пограничного слоя листьев, энергетический бюджет и, в конечном счете, на физиологию и рост растения. для управления циркуляцией воздуха можно использовать электрические вентиляторы. Сообщается, что удвоение концентрации CO2 в окружающей среде стимулирует скорость фотосинтеза и эффективность использования воды (WUE) у C. sativa. на 50 и 111% соответственно, что привело к увеличению общего роста [31].
Размножение семенами
Размножение, начиная с семян, является наиболее популярным и традиционным методом выращивания C. sativa. Семена этого вида нуждаются во влажной среде, в дополнение к теплу и циркуляции воздуха для оптимального прорастания. Для проращивания семян может быть использовано несколько методов. Наиболее популярным методом является посадка семян в небольшие биоразлагаемые горшочки, содержащие влажную, аэрированную почву. Тепловые коврики для рассады можно разместить под горшками, чтобы повысить температуру почвы и повысить всхожесть в течение зимы.
Прорастание семян начинается через четыре-пять дней, причем большинство жизнеспособных семян прорастает в течение 15 дней, в зависимости от сорта семян, возраста и условий хранения, а также температуры почвы и воды. Рассаду следует подвергнуть воздействию холодного флуоресцентного света (18-часовой фотопериод) для начального вегетативного роста, затем пересадить в большие горшки (30 × 30 см) и подвергнуть воздействию света полного спектра (18-часовой фотопериод) для желаемого вегетативного роста. Растения могут подвергаться воздействию 12-часового фотопериода, когда достигнут соответствующей вегетативной массы, которая вызывает цветение примерно через две недели. Мужские цветки появляются раньше женских, что позволяет отделять или отбраковывать мужские растения, если требуются бутоны “синсемиллы». Черенки с ветвей женских растений можно использовать для вегетативного размножения. Если требуется определенный химический профиль, следует провести химический анализ, чтобы помочь в выборе соответствующего хемотипа или клона.
Размножение черенками
Существует несколько способов вегетативного размножения растений C. sativa. Три основных типа-прививка, воздушное наслоение и использование черенков. Эти три типа называются макроразмножением, в отличие от микроразмножения или культивирования тканей. Размножение черенками является наиболее удобным, эффективным и в целом предпочтительным методом для C. sativa. Как только клон с определенным химическим профилем будет проверен и отобран, свежий узловой сегмент длиной около 6-10 см, содержащий по меньшей мере два узла от материнского растения, может быть использован для вегетативного/обычного размножения. Вегетативное размножение C. sativa может быть эффективно осуществлено с использованием либо твердой (почва), либо жидкой среды (гидропоника).
Для размножения в почве верхушечную ветвь срезают под углом 45° непосредственно под узлом и немедленно погружают в дистиллированную воду. Основание среза (2 см) затем окунают в гормон укоренения (Green Light, США) и высаживают в горшки (5 × 5 см), содержащие натуральную питательную среду coco и смесь (1:1) стерильной смеси для горшков и Fertilome® (Канна Континенталь, США). По крайней мере один узел должен быть покрыт почвой для эффективного укоренения. Растения регулярно орошаются и содержатся в контролируемых условиях окружающей среды. Укоренение начинается через две-три недели, а затем через шесть недель следует пересадка в большие горшки (например, 30 × 30 см).
Для размножения в гидропонике черенки помещают на глубину 2,5 см3 из каменной ваты или в поддерживающую среду из гидротонного глиняного шара. Растения снабжаются формулой растительного удобрения (Advance Nutrient, Канада) для вегетативного роста. Укоренение и пересадка аналогичны размножению в почве. Для вегетативного роста растения выдерживают в 18-часовом фотопериоде до тех пор, пока они не достигнут желаемого размера, а световой цикл меняется на 12-часовой фотопериод для цветения и созревания.
Микроразмножение
Метод культивирования тканей является мощным инструментом, который может быть использован в качестве альтернативы традиционному методу вегетативного размножения с целью повышения скорости размножения желаемых генотипов. Кроме того, культура растительных тканей является важной пограничной областью в биотехнологии растений и не только способствует массовому размножению, но и дает преимущества с точки зрения улучшения урожая и сохранения зародышевой плазмы, в частности, для вегетативно размножаемых культур. Хотя вегетативное размножение является стандартным для C. sativa, оно ограничено медленной скоростью размножения, плохой выживаемостью некоторых клонов и необходимостью обильной начальной посадки. Поэтому методы размножения in vitro предлагают мощные инструменты для массового размножения и сохранения зародышевой плазмы этого важного вида лекарственных растений. Собственные методологии, созданные авторами, привели к оптимизированным простым и эффективным протоколам микроразмножения C. sativa с использованием методов апикального узлового сегмента (прямой органогенез) и эксплантации листьев (косвенный органогенез) [32, 33].
В вышеупомянутом внутреннем протоколе прямого органогенеза апикальные узловые сегменты, содержащие почки (длиной около 1 см), использовались в качестве экспланта для инициации культур побегов. Экспланты были получены из здоровых ветвей скринированного и отобранного высокоурожайного клона C. sativa, выращенного в помещении для выращивания. Экспланты подвергали поверхностной дезинфекции с использованием 0,5% NaOCl (15% в/в отбеливатель) и 0,1% твина 20 в течение 20 мин. Экспланты трижды промывали в стерильной дистиллированной воде в течение 5 мин перед посевом на питательную среду. Микроразмножение и закаливание микроразмноженных растений проводили в соответствии с протоколом, описанным Латой и др. [36]. Наилучший ответ на индукцию побегов этого вида наблюдался при использовании среды Мурасиге и Скуга (MS), содержащей 0,5 мкм тидиазурон (TDZ). Хорошо развитые побеги затем переносили в среду MS половинной прочности с активированным углем, дополненным различными концентрациями индол-3-уксусной кислоты (IAA), индол-3-масляной кислоты (IBA) и нафталиновой уксусной кислоты (NAA) для укоренения. Самый высокий процент укоренения в микроразмножаемых растениях был достигнут в солях Мурасиге и Скуга половинной прочности (1/2 МС) с активированным углем 500 мг/дм3, добавленным 2,5 мкм МБА.
Для непрямого органогенеза каллус-опосредованная регенерация растений является простым способом получения сомаклональных вариантов, как было подчеркнуто для нескольких растений [34, 35]. Феномен сомаклональной изменчивости посредством косвенного органогенеза дает возможность раскрыть естественную изменчивость растений и использовать эту генетическую изменчивость для разработки новых продуктов и улучшения урожая [36]. На частоту сомаклональных изменений влияют многие факторы, такие как виды растений, генотип и тип участвующих эксплантов, протокол культивирования, применяемый в процессе in vitro, и, в частности, гормональный состав среды, а также количество субкультур [37, 38]. В лаборатории настоящих авторов была разработана система in vitro для получения каллусной культуры и регенерированных растений каннабиса из ткани листьев путем непрямого органогенеза высокоурожайного сорта C. sativa [33]. Калли были введены из эксплантов листьев на среде Мурасиге и Скуга, дополненной различными концентрациями (0,5, 1,0, 1,5 и 2,0 мкм) IAA, IBA, NAA и 2,4-дихлорфеноксиуксусной кислоты (2,4-D) в сочетании с 1,0 мкм тидиазуроном (TDZ). Оптимальный рост и поддержание каллуса обеспечивались при использовании 0,5 мкм этих ауксинов наряду с 1,0 мкм TDZ. Калли 2-месячного возраста культивировали в среде MS, содержащей различные концентрации цитокининов [6-бензоаминопурин (БАП), кинетин (Кн) и TDZ]. Скорость индукции и пролиферации побегов была самой высокой в 0,5 мкм ТДЗ. Регенерированные побеги лучше всего укореняются на среде MS с половинной прочностью, дополненной 2,5 мкм МБА различных используемых ауксинов (IAA, IBA и NAA).
Применение микроразмножения для крупномасштабного производства элитных клонов является эффективной и превосходной альтернативой семенам и обычным черенкам. Несмотря на свой потенциал, эта техника не оправдала ожиданий и по-прежнему сталкивается со многими проблемами. Одним из его основных ограничений является плохая выживаемость саженцев после перевода из условий in vitro в естественную неконтролируемую среду [39]. Эти проблемы ограничили применение технологии микроразмножения для массового производства многих ценных видов лекарственных растений. Кроме того, точность клонирования с точки зрения генетической стабильности, стабильного химического профиля и сопоставимого химического состава является одной из наиболее важных предпосылок микроразмножения видов растений, представляющих фармацевтический интерес. Поэтому для коммерческого использования крайне важно сравнить химический профиль, содержание полезных вторичных метаболитов и генетическую стабильность растений, выращенных in vitro, с материнскими растениями. В нашей лаборатории растения C. sativa, выращенные на культуре тканей, сравниваются с материнскими растениями и обычными растениями на предмет их генетической стабильности, профилей и содержания каннабиноидов.
Маркеры на основе ДНК с повторением простой последовательности (ISSR) успешно использовались в лаборатории авторов для мониторинга генетической стабильности микроразмноженных растений (с использованием апикальных узловых сегментов) C. sativa до 30 пассажей в культуре, которые отверждаются в почве в течение восьми месяцев [32]. Пятнадцать праймеров ISSR генерировали в общей сложности 115 отчетливых и воспроизводимых полос. Рисунок полосок для каждого праймера был однородным и сопоставимым с рисунком материнского растения, из которого были созданы культуры. Основываясь на полученных результатах, протокол микроразмножения стандартизирован для C. sativa можно использовать в коммерческих целях с минимальной возможностью любой изменчивости, вызванной in vitro.
Для оценки стабильности химического профиля в микроразмноженных растений, газовой хроматографии-пламенно-ионизационный обнаружения (ГХ-ПИД) был использован для оценки химических веществ и количественное определение каннабиноидов, чтобы выявить различия, если таковые имеются, в химический состав в лабораторных условиях размножается вегетативно растения против выращиваемых растений и материнским растением [32, 40]. В общем случае Δ9-ТГК содержание во всех группах увеличивалось с возрастом растений до самого высокого уровня на стадии бутонизации, когда содержание этого соединения достигало уровня до начала старения. Во всех группах растений картина изменений, наблюдаемых в концентрации других каннабиноидов в зависимости от возраста растений, следовала аналогичной тенденции. Качественно, профили каннабиноидов, полученные с использованием GC-FID в материнских растениях, растениях, выращенных вегетативно, и растениях, размноженных in vitro, были найдены похожими друг на друга и на профили выращенных в полевых условиях материнских растений C. sativa. Незначительные различия, наблюдаемые в концентрации каннабиноидов внутри и между группами, не были статистически значимыми. Эти результаты подтвердили клональную точность наших растений C. sativa, размноженных in vitro, и предполагают, что протоколы, используемые в этих исследованиях для получения растений, размножаемых микроразмножением, не влияют на результирующий метаболический профиль. Кроме того, этот подход может быть использован для массового размножения растений этого вида, соответствующих типам, для коммерческого фармацевтического использования.
Сбор, переработка и хранение биомассы сативы каннабиса
Определение оптимальной стадии сбора урожая является критическим этапом в культивировании C. sativa для обеспечения требуемого химического профиля, например, оптимального содержания Δ9-ТГК. Это может быть достигнуто путем ежедневного анализа содержания каннабиноидов в различных частях растения. Содержание ТГК увеличивается с возрастом растения до самого высокого уровня на стадии бутонизации, после чего оно достигает плато примерно в течение одной-двух недель, а затем снижается с началом старения. Кроме того, содержание ТГК обычно выше до полудня. Верхние зрелые почки могут быть собраны первыми, давая время для созревания нижних незрелых почек. Визуальным признаком зрелости является цвет рыльцев, которые сморщиваются и становятся коричневыми по мере созревания цветов.
Коммерческий амбар для сушки табака, такой как BulkTobac (Gas-Fired Products, Inc., США), может использоваться для сушки биомассы при крупномасштабном выращивании (12-15 ч, 40°C); лабораторная печь может использоваться для небольших образцов (ночь, 40°C). Опавшие листья и стебли следует удалить из зрелых почек перед сушкой. Целые бутоны можно высушить, или бутоны можно разрезать на более мелкие кусочки. Высушенный растительный материал можно обработать вручную. Все оставшиеся листья следует отделить от почек. Почки тщательно пропускают через сита разного размера, чтобы отделить мелкие стебли и семена. Автоматизированные машины для обработки растений также могут использоваться для отделения крупных стеблей и семян от полезной биомассы.
Надлежащим образом высушенную и обработанную биомассу каннабиса можно хранить в полиэтиленовых пакетах, одобренных FDA, помещенных в герметичные волокнистые барабаны (кратковременная температура: 18-20°C; долгосрочная температура: -10°C). Основной проблемой при хранении C. sativa является стабильность многих каннабиноидов. Деградация ТГК незначительна во время обработки, особенно когда материал хорошо высушен и запечатан; однако он по-прежнему чрезвычайно чувствителен к кислороду и ультрафиолетовому излучению, и медленная деградация происходит при хранении при комнатной температуре путем окисления до каннабидиола (CBD). Кроме того, легко преобразуется в (−)-Δ8—транс-тетрагидроканнабинол (Δ8-ТГК) под термодинамическим контролем. Поэтому предпочтительными условиями для длительного хранения являются низкая температура и отсутствие света.
Хемотаксис* каннабиса
Каннабис сатива-химически сложный вид, это вывод основан на наличии многочисленных подтвержденных природных компонентах и вторичных метаболитов. Концентрация Δ9-ТГК в высушенном соцветии (листьях и бутонах) используется для определения его психоактивности. Количественный и качественный анализ каннабиса может быть использован для характеристики его фенотипа и фитоканнабиноидного профиля [25].
Коноплю можно разделить на три фенотипа: фенотип I (наркотический тип), с Δ9-ТГК (>0,5%, а каннабидиол (CBD) <0.5% (Δ9-ТГК/CBD ≫ 1)); промежуточный фенотип II (промежуточного типа), с CBD в качестве основных каннабиноидов, но при этом Δ9-ТГК также присутствует в различных концентрациях (Δ9-ТГК/CBD ~ 1); и фенотип III (в волокна типа или конопли), с особенно низким Δ9-ТГК, содержание (Δ9-ТГК/CBD ≪ 1). Конопля обычно содержит непсихоактивные каннабиноиды в качестве основных компонентов, например, CBD или каннабигерол (CBG) [41, 42]. Хотя факторы окружающей среды играют роль в определении количества каннабиноидов, присутствующих в разных частях растения на разных стадиях роста [43], соотношения CBD:Δ9-THC, очевидные в большинстве популяций, находятся под генетическим контролем [44].
Биосинтез фитоканнабиноидов
Фитоканнабиноиды представляют собой терпенофенольные соединения, химически связанные с терпенами, с их кольцевой структурой, полученной из геранилпирофосфата (монотерпеновая субъединица C 10). Цитозольный мевалонат и пластидиальный метилэритритфосфат (MEP) являются двумя независимыми путями, которые, как сообщается, отвечают за биосинтез терпеноидов растений. Сообщается, что пластидиальный метилэритрит фосфат отвечает за биосинтез каннабиноидной терпеноидной части [45]. Первый шаг в пути биосинтеза каннабиноидов (схема 1) является образованием оливковой кислоты, путь биосинтеза которой до конца не выяснен. Однако было высказано предположение, что в этом может быть задействована поликетидсинтаза III типа, оливетолсинтаза [46]. Оливковая кислота и геранилдифосфат соединяются под влиянием пренилазы, геранилдифосфат:геранилтрансфераза оливкового масла, образующая каннабигероловую кислоту (CBGA). Это, в свою очередь, окисляется циклическими флавин-адениндинуклеотидзависимыми (FAD) оксидазами, а именно Δ9-тетрагидроканнабиноловой кислотой (Δ9-THCA) синтаза, синтаза каннабидиоловой кислоты (CBDA) и синтаза каннабихроменовой кислоты (CBCA), продуцирующая Δ9-тетрагидроканнабиноловую кислоту, каннабидиоловую кислоту и каннабихроменовую кислоту [47, 48].
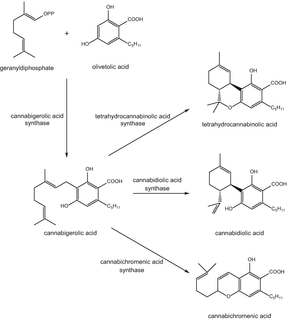
Биосинтез тетрагидроканнабиноловой кислоты (ТГКА) и родственных каннабиноидов
Состав каннабиса сативы
Общее количество природных соединений, идентифицированных или выделенных из C. sativa, продолжало увеличиваться в течение последних нескольких десятилетий. В 1980 году Тернером и др. сообщалось о 423 соединениях этого растения [49], и это число увеличилось в 1995 году до 483 [50]. В период с 1995 по 2005 год было добавлено семь соединений [51]. Основное внимание в этой главе уделяется химическому описанию недавно зарегистрированных 49 каннабиноидов, а также 26 неканнабиноидных компонентов (таблица 1), в общей сложности 565 соединений, идентифицированных на сегодняшний день.
Каннабиноиды
Натуральные продукты, выделенные из C. sativa, имеющие типичный терпенофенольный скелет C21, называются “каннабиноидами». Этот класс соединений имеет производные и продукты трансформации, которые также считаются каннабиноидами. С момента начала химических исследований C. sativa на сегодняшний день было выделено в общей сложности 120 каннабиноидов (Таблица 1), которые можно разделить на 11 общих типов: (−)-Δ9—транс-тетрагидроканнабинол (Δ9-ТГК), (−)-Δ8—транс-тетрагидроканнабинол (Δ8-THC), каннабигерол (CBG), каннабихромен (CBC), каннабидиол (CBD), каннабинодиол (CBND), каннабиелсоин (CBE), каннабициклол (CBL), каннабинол (CBN), каннабитриол (CBT) и другие типы.
Таблица 1
Компоненты C. sativa L. по химическому классу
|
Химический класс |
2005 |
2015 |
|---|---|---|
|
Δ9-Тип ТГК |
9 |
23 |
|
Δ8-Тип ТГК |
2 |
5 |
|
Тип CBG |
8 |
16 |
|
Тип CBC |
6 |
9 |
|
Тип |
7 |
7 |
|
Тип CBND |
2 |
2 |
|
Тип CBE |
5 |
5 |
|
Тип CBL |
3 |
3 |
|
Тип CBN |
7 |
11 |
|
Тип ТОС |
9 |
9 |
|
Разные типы |
14 |
30 |
|
Общее количество каннабиноидов |
72 |
120 |
|
Всего неканнабиноидов |
419 |
445 |
|
Всего |
491 |
565 |
(−)-Δ9 -транс-Тетрагидроканнабинол (Δ9-ТГК) типа
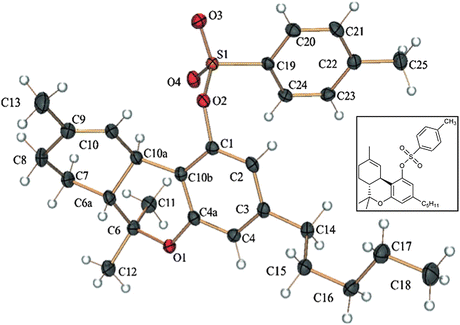
Гаони и Мехулам впервые сообщили о структуре Δ9-THC (1) и определили его абсолютную конфигурацию как транс-(6aR,10aR) [52]. Недавно рентгенокристаллический анализ тозилатного эфира 1 подтвердил его ранее заданную конфигурацию (рис. 1). Сложный эфир тозилата использовался для рентгеновской кристаллографии, так как свободное соединение не кристаллизуется [53]. Наряду с его химией были также раскрыты психотропные свойства 1.
Растущий интерес к C. sativa и ее компонентам привел к активизации исследований в этой области и, как следствие, появлению ряда обзоров на эту тему [49, 50, 51]. Недавно Ахмед и др. выделили восемь новых соединений тетрагидроканнабинольного типа [54], как показано на рис. 2. Эти новые каннабиноиды были определены как β-fenchyl Δ9-tetrahydrocannabinolate (2), α-fenchyl Δ9-tetrahydrocannabinolate (3), Эпи-борнил Δ9-tetrahydrocannabinolate (4), борнил Δ9-tetrahydrocannabinolate (5), α-terpenyl Δ9-tetrahydrocannabinolate (6), 4-terpenyl Δ9-tetrahydrocannabinolate (7), α-кадинил Δ9-тетрагидроканнабинолат (8) и γ-эвдесмил Δ9-тетрагидроканнабинолат (9). Их структуры (рис. 2) были установлены на основе спектроскопического анализа ЯМР и ГХ-МС в виде моно — или сесквитерпеноидных эфиров Δ9-тетрагидроканнабиноловой кислоты А, предшественника Δ9-ТГК. В условиях высокой температуры используемого анализа GC-MS эти соединения распадаются на два компонента с образованием Δ9-ТГК и моно — или сесквитерпена. Эти сложные эфиры каннабиноидов были выделены из высокоэффективного C. sativa разнообразие с использованием нескольких хроматографических методов, включая вакуумно-жидкостную хроматографию (VLC), полупрепаративную ВЭЖХ C 18 и полупрепаративную энантиоселективную хиральную ВЭЖХ [54]. В недавней публикации Зульфикар и др. выделил димерный каннабиноид под названием каннабизол (10) (рис. 2) из образцов с высоким содержанием каннабигерола (21), полученных в рамках программы мониторинга эффективности C. sativa, с использованием колоночной хроматографии с силикагелем. Анализ GC-MS каннабизола (10) показал два диагностических ионных пика при m/z 314 и m/z 328, соответствующих Δ9-ТГК и 2-метил-Δ9-ТГК [55]. Радван и др. выделили и идентифицировали 8α-гидрокси-Δ9-тетрагидроканнабинол (11), 8β-гидрокси-Δ9-тетрагидроканнабинол (12) и 11-ацетокси-Δ9-тетрагидроканнабиноловую кислоту А (13) из высокоэффективного образца C. sativa [56]. Альдегид Δ 9-ТГК (14) и 8-оксо-Δ9-ТГК (15) также были выделены из того же сорта [57] (рис. 2).
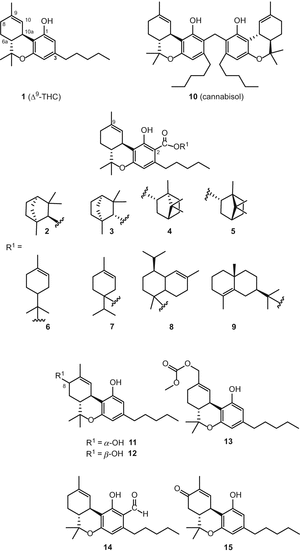
(−)-Δ8 -транс-Тетрагидроканнабинол (Δ8-ТГК) типа
На протяжении многих лет, только два Δ8-ТГК–типа каннабиноидов, в частности, Δ8—транс-тетрагидроканнабинол (16, Δ8-ТГК) и Δ8—транс-тетрагидроканнабиноловой кислоты (17, Δ8-THCA) (Рис. 3), были отмечены с начала химические исследования С. Sativa [58, 59]. Недавно в нашей группе выделено три больших соединения этого типа [55, 56], которые были определены как 10α-гидрокси-Δ8-тетрагидроканнабинол (18), 10β-гидрокси-Δ8-тетрагидроканнабинол (19) и 10аα-гидрокси-10-оксо-Δ8-тетрагидроканнабинол (20) (Рис. 3).
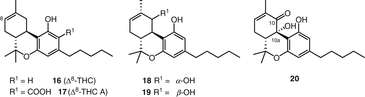
Тип каннабигерол (CBG)
Каннабигерол (21) (CBG) был первым соединением, выделенным в чистом виде из смолы Cannabis sativa [60]. Из каннабиноидов каннабигерольного типа до 2005 года было опубликовано восемь соединений [51], в то время как недавно сообщалось о еще девяти новых каннабиноидах этого типа (рис. 4). Из них семь соединений (22-28) были выделены из почек зрелого женского растения высокоэффективного сорта C. sativa. Радван и др. выделенный 5-ацетил-4-гидрокси-каннабигерол (22), (±)-6,7-транс-эпоксиканнабигерольная кислота (23), (±)-6,7-цис-эпоксиканнабигерольная кислота (24), (±)-6,7-снг-эпоксиканнабигерол (25) и (±)-6,7-транс-эпоксиканнабигерол (26) из высокоэффективного C. sativa [61, 62]. Два сложных эфира каннабигероловой кислоты, γ-эвдесмил-каннабигеролат (27) и α-кадинил-каннабигеролат (28), были выделены с использованием энантиоселективной ВЭЖХ из одного и того же высокоэффективного сорта [54]. В 2008 году Аппендино и др. очистил новое, полярное производное дигидроксиканнабигерола (кармагерол) (29) из ацетонового экстракта надземных частей C. sativa сорта “карма”. В их процедуре экстракт C. sativa был фракционирован на RP C18 колонка силикагеля с последующей хроматографией на колонке силикагеля и последующим использованием ВЭЖХ в нормальной фазе для выделения соединения 29 [63]. Сесквиканнабигерол (30), липофильный аналог каннабигерола, был выделен Полластро и др. из воскообразной фракции разновидности волокнистой конопли “карма” после гидролиза воска метанольным КОН и очистки с помощью колоночной хроматографии с силикагелем на гравитационной колонке с последующей хроматографией вспышкой над нейтральным глиноземом [64].
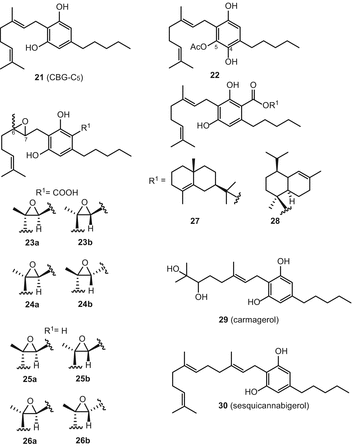
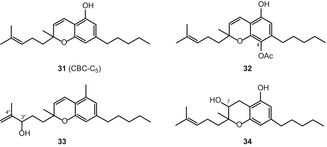
Тип каннабихромен (CBC)
Исследовательские группы Клауссена и др. а Гаони и Мехулам независимо раскрыли структуру каннабихромена (31) (CBC) в 1966 году [65, 66]. Элсоли и Слейд впоследствии сообщили о шести каннабиноидах каннабихроменного типа [51]. В недавней публикации было описано в отрыве от высокоэффективный С. Sativa трех новых cannabichromene-тип каннабиноиды (Рис. 5), а именно, (±)-4-acetoxycannabichromene (32), (±)-3″-гидрокси-Δ4″-cannabichromene (33) и (−)-7-hydroxycannabichromane (34), путем применения геля кремнезема вакуума-жидкостной хроматографии (в VLC), а также силикагель и с18 ВЭЖХ [62].
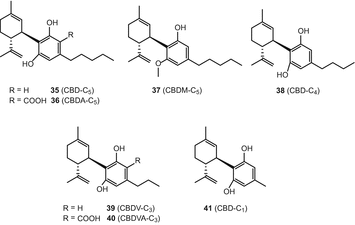
Тип каннабидиол (CBD)
Каннабидиол (35) (CBD) и каннабидиоловая кислота (36) (CBDA) являются основными метаболитами непсихотропных (волокнистых) разновидностей C. sativa. Adams и др. выделили каннабидиол (CBD) в 1940 году [67], в то время как Петржилка и др. сообщили о своем синтезе и абсолютной конфигурации как (−)-транс-(1R,6R) [68]. Семь каннабидиол-тип каннабиноидов [(−)-каннабидиол (КБР), (35), каннабидиоловая кислота (к cbda) (36), каннабидиол монометилового эфира (CBDM) (37), каннабидиол-с4 (КБР-с4) (38), (−)-cannabidivarin (CBDV) (39), cannabidivarinic кислоты (CBDVA) (40), и cannabidiocol (КБР-с,1) (41)] были включены в обзор 2005 года, проведенный Элсоли и Слейдом (рис. 6) [51]. С 2005 года не сообщалось о новых каннабиноидах типа CBD.
Тип каннабинодиол (CBND)
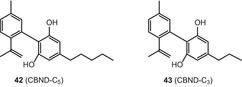
Каннабиноиды каннабиноидного типа являются ароматизированными производными каннабидиола (CBD). Каннабинодиол (CBND-C5) (42) и CBND-C3 (каннабинодиварин) (43) (рис. 7) являются единственными двумя соединениями из этого подкласса, которые были охарактеризованы в C. sativa [49, 51].
Тип каннабиелсоин (CBE)
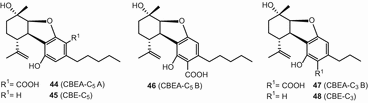
Пять cannabielsoin (све)-тип каннабиноидов с одинаковой абсолютной конфигурации (5Ас,6С,9Р,9АР) были описаны [49], и назвал cannabielsoic кислоты (CBEA-с5 А) (44), cannabielsoin (све) (45), cannabielsoic кислоты B (CBEA-с5 Б) (46), cannabielsoic кислоты, Б, в3 (CBEA-с3 Б) (47), и C3-cannabeilsoin (КБ3-с3) (48). Эти каннабиноидные изоляты типа CBE были охарактеризованы из C. sativa [69]. Кроме того, они были идентифицированы как метаболиты CBD у млекопитающих [70] (рис. 8).
Тип каннабициклол (CBL)
Каннабициклол (CBL) (49), каннабициклоновая кислота (CBLA) (50) и каннабицикловарин (CBLV) (51) (рис. 9) являются единственными представителями этого подкласса [71, 72, 73, 74, 75].
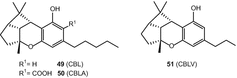
Тип каннабинол (CBN)
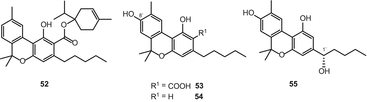
Семь производных каннабинола были включены в обзор 2005 года [51]. Кроме того, Ахмед и др. выделен 4-терпенил каннабинолат (52) (рис. 10) из высокоэффективной разновидности C. sativa [54]. При анализе GC-MS соединение 52 фрагментировалось до CBN и монотерпенола. Этот каннабиноид был выделен полупрепаративным энантиоселективным методом ВЭЖХ. Кроме того, 8-гидроксиканнабиноловая кислота А (53) и 8-гидроксиканнабинол (54) (рис. 10) были выделены из той же разновидности C. sativa [62]. Соединение 54, которое первоначально было получено в качестве синтезированного продукта [76], был впервые выделен из природного источника с использованием процедуры твердофазной экстракции C 18 (SPE). Ахмед и др. недавно сообщалось об выделении (1-Х) — гидроксиканнабинола (55) (рис. 10) из высокоэффективного образца C. sativa [57].
Тип каннабитриол (CBT)
Каннабитриол был первоначально зарегистрирован Обатой и Исикавой в 1966 году [77], но его химическая структура была выяснена десятилетием позже, в 1976 году [78]. Конфигурация этого соединения была позже определена с помощью рентгеновского анализа [79]. Кроме того, девять ТОС — тип каннабиноидов, в том числе (−)-транс-cannabitriol ((−)-транс-БТ-с5) (56), (+)-транс-cannabitriol ((+)-транс-ТОС-с5) (57), (±)-цис-cannabitriol ((±)-цис-ТОС-З.5) (58), (−)-транс-10-ethoxy-9-гидрокси-Δ6а(10а)-тетрагидроканнабинола ((−)-транс-БТ-тон-с5) (59), (±)-транс-cannabitriol-с3 ((±)-транс-ТОС-с3) (60), кпт-с3 гомолог (неизвестно стереохимии) (ЦБТ-с3-гомолог) (61), (−)-транс-10-ethoxy-9-гидрокси-Δ6а(10а)-tetrahydrocannabivarin-с3 ((−)-транс-БТ-тон-с3) (62), 8,9-дигидрокси-Δ6а(10а)-тетрагидроканнабинола (8,9-Ди-о-ТМС-с5) (63), и каннабидиоловая кислота tetrahydrocannabitriol эфира (к cbda-с5 9-О-ТМС-с5 эфир) (64) (рис. 11) были упомянуты в предыдущем обзоре [50]. Тем не менее, два этокси каннабитриола, (−)-транс-CBT-OEt-C5 (59) и (−)-транс-CBT-OEt-C3 (62), вероятно, являются артефактами, поскольку этанол использовался для их выделения из C. sativa [80, 81].
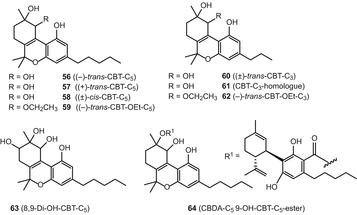
Разные типы каннабиноидов
Различные типы каннабиноидов были обобщены в обзоре Элсоли и Слейда [51]. Эти соединения включены dehydrocannabifuran (DCBF-с5) (65), cannabifuran (БНВ-с5) (66), 8-гидрокси-isohexahydrocannabivirin (о-ИСО-HHCV-с3) (67), cannabichromanone-с5 (CBCN-с5) (68), cannabichromanone-с3 (CBCN-с3) (69) (Рис. 12)
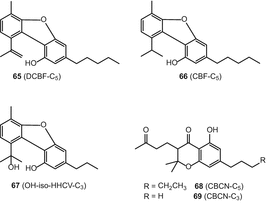
10-оксо-Δ6а(10а)-тетрагидроканнабинола (OTHC) (70), cannabicitran (71), (−)—Δ9—цис-(6аз,10аР)-тетрагидроканнабинола (СНГ-Δ9-ТГК) (72) cannabicoumaronone (CBCON-с5) (73) (рис. 13)
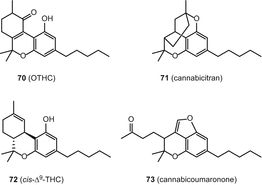
Сannabiripsol (ЦБ РФ) (74), cannabitetrol (CBTT) (75), (±)-Δ7—СНГ-isotetrahydrocannabivarin-с3 (СНГ-ИСО-Δ7-THCV) (76), (−)-Δ7—транс-(1р,3р,6Р)-isotetrahydrocannabivarin-с3 (транс-ИСО-Δ7-THCV) (77) и (−)-Δ7—транс-(1р,3р,6Р)-isotetrahydrocannabinol-с5 (транс-ИСО-Δ7-ТГК) (78) (Рис. 14).
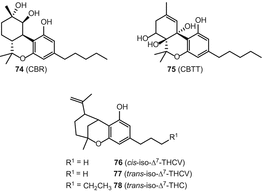
Однако в более позднем обзоре каннабихроманоны и каннабикумарононы были выделены в отдельные группы в результате уточненной классификации [82]. Из высокоэффективной разновидности C. sativa, Ahmed и др. выделили три каннабихроманона (рис. 15), которые были названы каннабихроманонами B (79), C (80) и D (81). Абсолютная конфигурация трех соединений была определена на основе дериватизации сложных эфиров Мошера и проверки их спектров кругового дихроизма [83]. Выделение этих соединений проводили с использованием полупрепаративной ВЭЖХ C 18. (−)-(7R)-Каннабикумароновая кислота (82), 4-ацетокси-2-geranyl-5-гидрокси-3-н-pentylphenol (83), и 2-geranyl-5-гидрокси-3-н-пентил-1,4-бензохинона (84) (рис. 15) были выделены из почек и листьев той же разновидности конопли, за счет применения ряда хроматографических методов, в том числе вакуумно-жидкостной хроматографии (Валенсия) над силикагелем, твердофазная экстракция разделительной колонне (с18 оин), и нормально-фазовой ВЭЖХ [62]. Спектр CD 82 показал положительный эффект хлопка при 246 нм и отрицательный при 295 нм, что указывает на конфигурацию (7R) [61]. Кроме того, 5-ацетокси-6-геранил-3-н-пентил-1,4-бензохинон (85) (рис. 15) был выделен с помощью колоночной хроматографии на силикагеле с последующим ВЭЖХ в нормальной фазе [84]. Радван и др. классифицированное соединение 85 ошибочно как неканнабиноид [83]; однако, поскольку оно является ацетоксипроизводным терпенофенола C21, его классификацию следует пересмотреть, чтобы включить в класс компонентов каннабиноидов.
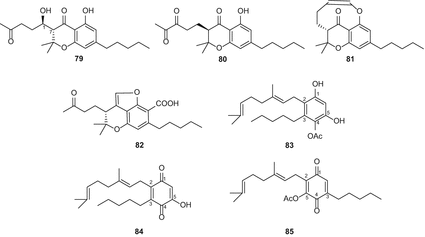
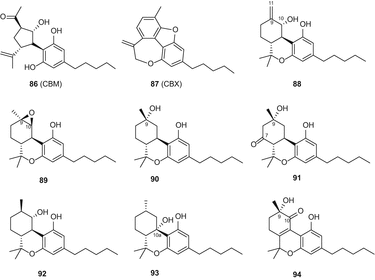
В 2010 году Тальялатела-Скафати и др. выделил новый каннабиноид под названием каннабимовон (CBM) (86) (рис. 16) из непсихотропной разновидности C. sativa [85]. Этот необычный метаболит, предположительно, образуется из каннабидиола и был выделен из полярной фракции конопли с помощью флэш-хроматографии насиликагеле C 18 с обратной фазой с последующей ВЭЖХ в нормальной фазе [85]. Пагани и др. выделил тетрациклический каннабиноид каннабиоксепан (CBX) (87) (рис. 16) из сорта” караманьола » C. sativa [86]. Недавно Радван и др. [55] и Ахмед и др. [57] изолированные шесть каннабиноидов из высокоэффективный разнообразные С. Sativa , которые были определены как 10α-гидрокси-Δ9,11-hexahydrocannabinol (88), 9β,10β-epoxyhexahydrocannabinol (89), 9α-hydroxyhexahydrocannabinol (90), 7-оксо-9α-hydroxyhexahydrocannabinol (91) 10α-hydroxyhexahydrocannabinol (92), 10аР-hydroxyhexahydrocannabinol (93), и 9α-гидрокси-10-оксо-Δ6а,10а-тетрагидроканнабинол (94) (рис. 16).
Неканнабиноидные компоненты
В дополнение к каннабиноидам ранее из C. sativa были получены сотни компонентов, относящихся к широкому спектру химических классов [49, 50, 51]. В дополнение к 419 ранее известным неканнабиноидным вторичным метаболитам C. sativa, с 2005 года из этого растения было выделено 26 неканнабиноидов (Рис. 17–23). Семь соединений, а именно, cannflavin с (95), chrysoeriol (96), 6-prenylapigenin (97), 4,5-дигидрокси-2,3,6-trimethoxy-9,10-dihydrophenanthrene (98), 4-гидрокси-2,3,6,7-tetramethoxy-9,10-dihydrophenanthrene (99), 4,7-диметокси-1,2,5-trihydroxyphenanthrene (100) (Рис. 17), и β-ситостерил-3-О—β—d-глюкопиранозид-2′-О-пальмитат (101) были выделены из высокоэффективной разновидности C. sativa [84].
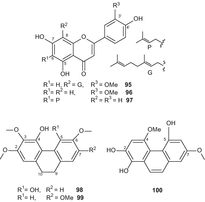
Соединение 101 выделяли методом колоночной хроматографии в силикагеле с последующей твердофазной экстракцией в нормальной фазе, в то время как соединение 96 очищали методом колоночной хроматографии в силикагеле с последующей хроматографией в обратной фазе. Соединения 95, 99и 100 были очищены с помощью колоночной хроматографии с силикагелем, твердофазной экстракции в нормальной фазе и ВЭЖХ C 18. Новое соединение, 9,10-дигидро-2,3,5,6-тетраметоксифенантрен-1,4-дион (102) был выделен из листьев и ветвей C. sativa методом силикагелевой хроматографии и пропускания через сефадекс LH-20 с последующей полупрепаративной жидкостной хроматографией [87]. Докозановые кислоты метилового эфира (103) (рис. 18),
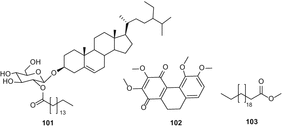
ацетил-стигмастерол (104), α-spinasterol (105), 1,3,6,7-парфюмерии и т. п. Страница 2-с—β—д-глюкопиранозил-ксантонами (106) (рис. 19), апигенин-6,8-Ди-с—β—д-глюкопиранозида (107), урацил (108) и quebrachitol (109) были изолированы из петролейного эфира и Н-бутанол фракций из метанольного экстракта конопли листья и ветви [88].
Авторы указали, что квебрахитол (109) был впервые выделен из C. sativa [88]; однако об этом конкретном соединении уже давно сообщалось от этого вида [49]. Цянь и др. выделили каннабсин А (110) (рис. 20), изоселахоцериановую кислоту (111), β-ситостерин (112) и маннит (113) из плодов C. sativa [89]. Эти соединения были очищены последовательной колонкой силикагеля и колоночной хроматографией Sephadex LH-20 [89].
Хотя авторы впервые заявили об выделении этих пяти соединений из C. sativa [89], β-ситостерин (112) и маннит (113) ранее были описаны у этого вида [49]. 5′-метил-4-пентилбифенил-2,6,2′-триол (114) (рис. 21) и 7-метоксиканнабиспирон (115) были выделены из высокоэффективной разновидности C. sativa с использованием хроматографии в нормальной фазе с последующим ВЭЖХ C 18 [61].
В 2011 году Пагани и др. сообщили об выделении изоканнабиспирадиенона (116) и двух полиненасыщенных гидроксижирных кислот, 117 и 118 (рис. 22), из волокнистого сорта C. sativa сорта “кармагнол” с использованием флэш-хроматографии RP-C18 и ВЭЖХ в нормальной фазе [86].
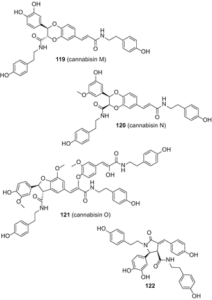
В 2015 году Ян и др. выделили четыре новых лигнанамида, каннабизин М (119), каннабизин N (120), каннабизин О (121), и 3,3′-деметил-гелиотропамид (122) из этилацетатного экстракта семян конопли (рис. 23), используя комбинацию обращенно-фазовой хроматографии под средним давлением, прохождения через Сефадекс LH-20 и RP-ВЭЖХ [90].
Анализ каннабиноидов в сативе каннабиса и ее пророизводных
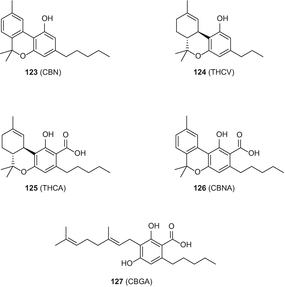
В литературе описано несколько методов анализа сативы каннабиса и ее производных (марихуаны, гашиша и гашишного масла). Эти методы были сосредоточены главным образом на идентификации, обнаружении и количественном определении каннабиноидов, включая как кислые, так и нейтральные вещества этого типа. Особое внимание было направлено на возможные лекарственные свойства, (−)-транс-Δ9-тетрагидроканнабинола (Δ9-ТГК) (1), каннабигерола (CBG) (21), каннабихромена (ПГС) (31), каннабидиола (CBD) (35), каннабинола (ЭЛЬБОРА) (123) (Рис. 24), и тетрагидроканнабиварина (THCV) (124) (рис. 24), а также возможность использования для судебно-медицинских целей [91].
Для достижения вышеупомянутых целей использовались разнообразные аналитические подходы, методы и инструменты с различным уровнем чувствительности и специфичности. Наиболее широко применяемыми методами анализа каннабиса были ГХ/МС и ВЭЖХ [92, 93, 94, 95, 96, 97]. Газовая хроматография/масс-спектрометрия гораздо чаще используется для этой цели, несмотря на присущий ей недостаток, заключающийся в том, что она вызывает термическое декарбоксилирование кислых каннабиноидов до их нейтральной формы, если только растительный экстракт не получен химическим путем. В отличие от этого, ВЭЖХ не влияет на структуру каннабиноидов, что позволяет анализировать исходные соединения, присутствующие в растительном экстракте. Однако у него есть минус — недостаточное разрешение всего спектра каннабиноидов. Ниже приведен обзор методов, описанных в литературе для анализа C. сативных производных.
Морита и Андо описали метод GC-MS для анализа нескольких каннабиноидов в гашишном масле. Используя этот метод, одиннадцать соединений, включая Δ9-ТГК (1), CBC (31), CBD (35) и CBN (123) (рис. 24), наряду снекоторыми гомологами C3, были разрешены и идентифицированы. В этом отчете авторы предложили структуры дляфрагментов пика Δ 9-ТГК на основе их наблюдаемых масс [98].
Бреннейсен и ЭлСохли описали метод, который объединил капиллярную газовую хроматографию высокого разрешения с детекцией ионизации пламени (GC-FID) и GC-MS для идентификации соединений в экстрактах C. sativa, чтобы установить корреляцию между их химическими профилями и географическим происхождением растительных материалов. Анализируемые компоненты включали терпены, алканы, каннабиноиды и неканнабиноидные фенолы. Было идентифицировано более 100 различных соединений, и процедура оказалась надежной и применимой при проведении судебных экспертиз для определения географического происхождения C. sativa. образцы по их химическим профилям [99].
В другом исследовании ВЭЖХ-УФ использовался для разрешения смесей кислых и нейтральных каннабиноидов с использованием колонки Beckman Ultrasphere 3 мкм ODS. В полученном следе ВЭЖХ было обнаружено более 40 компонентов [91].
Хида и др. опубликована процедура классификации сортов гашиша на основе проверки их профилей пиролизно-газовой хроматографии в присутствии порошкообразного хрома, и полученные данные впоследствии были подвергнуты кластерному анализу нормализованных пирограмм. В этой работе пики в каждой пирограмме были нормализованы по отношению к присутствующему самому высокому пику. Результаты кластерного анализа были представлены в виде четко интерпретированных визуальных представлений дендрограмм. Дендограммы могут быть использованы для сравнения неизвестных образцов гашиша с образцами из различных источников в целях классификации [100].
Метод GC-FID был разработан Россом и др. для рутинного анализа конфискованных образцов марихуаны и количественного определения каннабиноидов, включая Δ9-THC (1), CBG (21), CBC (31), CBN (35), CBN (123) (рис. 24) и THCV (124) (рис. 24). Используемая процедура включала экстракцию небольшого количества образца (100 мг) смесью метанола и хлороформа (99:1), содержащей внутренний стандарт (4-андростен-3,17-дион), с последующим прямым анализом экстракта на колонке DB-1 [101].
Вересс и др. сообщил о раннем методе сравнительного анализа нейтральных каннабиноидов с помощью ВЭЖХ с использованием двух различных типов колонок со связанной фазой. В этом исследовании колонка с аминосвязанной фазой использовалась для разделения компонентов растительного материала неполярными растворителями с использованием прямого впрыска экстракта без предварительной очистки. Результаты с использованием этой колонки сравнивались с результатами, полученными с использованием колонки с обратной фазой, где последняя требовала очистки образца, используя C18-Картридж Sep-Pak перед анализом ВЭЖХ. Было показано, что использование колонки с аминосвязью превосходит колонку с обратной фазой для количественного определения нейтральных каннабиноидов [102].
Несколько аналитических методов, включая TLC, GC-FID с упакованными и капиллярными колонками и ВЭЖХ, были подробно описаны для анализа нейтральных и кислых каннабиноидов в продуктах C. sativa (марихуана, гашиш и гашишное масло) в руководстве, подготовленном в 1987 году Отделом наркотических средств Организации Объединенных Наций [103]. Это руководство включало подборку методов отбора проб и анализа продуктов C. sativa, рекомендованных для использования Национальными лабораториями по наркотикам. Количество ТГК (1) в масле семян конопли определяли с помощью аналитической процедуры GC-MS, опубликованной Боси и Коулом [104]. Содержание Δ9-ТГК (1) и тетрагидроканнабиноловой кислоты (ТГК) (125) (рис. 24) в продуктах, содержащих коноплю, определяли методом ВЭЖХ [105]. Кроме того, общиеуровни концентрации Δ 9-ТГК (1) как в семенах C. sativa лекарственного, так и волокнистого типа были определены Россом и др. следуя процедуре GC-MS [106]. Pellegrini et al. опубликовал метод, сочетающий жидкостно-жидкостную экстракцию с GC-MS для количественного определения Δ9-ТГК (1), CBD (35) и CBN (123) (рис. 24) в различных продуктах и напитках, содержащих коноплю. Диетическими продуктами, включенными в это исследование, были пиво, пастила, ликер, семена, душистая трава и масло. В этой процедуре, в которой Δ8-ТГК (16) использовался в качестве внутреннего стандарта, твердые и жидкие образцы экстрагировали гексанами/изопропанолом (9:1) и анализ проводили на капиллярной колонке из плавленого кремнезема. Силилированные образцы анализировали в режиме мониторинга выбранных ионов (SIM). Было установлено, что уровни количественной оценки составляют 1 нг/г для Δ9-ТГК и CBN и 2 нг/г для CBD. Уровни Δ9-Содержание ТГК в различных продуктах из конопли варьировалось в 50 раз. Полученные данные показали, что большинство проанализированных образцов были получены из каннабиса наркотического типа [107].
Количественная оценка отдельных каннабиноидов требует использования внутренних стандартов, которые варьируются в зависимости от используемого метода. Они включали использование углеводородов с длинной цепью (например, n-тетрадекан или n-докозан), стероидов (андрост-4-ен-3,17-дион и холестан) и фталатов (дибензилфталат или ди-n-октилфталат) [91].
В другом опубликованном исследовании, ВЭЖХ, с использованием обращенно-фазовой колонки (7 мкм размер частиц) и смесь метанола и 0,01 м серной кислоты (80:20), в качестве подвижной фазы была использована при анализе Δ9-ТГК (1), КБР (35), и кубическим нитридом бора (123), вместе с их соответствующей карбоновой кислоты форм, тетрагидроканнабиноловой кислоты (THCA) (125) (рис. 24), каннабидиоловая кислота (к cbda) (36) и cannabinolic кислоты (ЦБА) (126) (рис. 24). Авторы применили стандартные условия хранения образцов гашиша вместе с чистыми каннабиноидами и пришли к выводу, что общие значения CBD/CBDA-C5, CBN/CBNA и Δ9-THC/THCA были полезны для оценки образцов гашиша [108].
Хазекамп и партнеры разработали спектроскопический метод 1 Ч-ЯМР для количественного анализа каннабиноидов в C. sativa. Было обнаружено, что отличительные сигналы для каннабиноидов находятся в диапазоне δ H 4,0–7,0 промилле от 1Спектр Н-ЯМР, с использованием антрацена в качестве внутреннего стандарта. Количественное определение целевых соединений было достигнуто путем вычисления относительного отношения площадей пиков выбранных протонных сигналов целевого соединения к известному количеству внутреннего стандарта. Этот метод позволяет проводить простое и быстрое количественное определение каннабиноидов без предварительной хроматографической очистки, занимая всего 5 минут времени анализа [109].
Элиас и Лоуренс в книге по анализу наркотиков, вызывающих злоупотребление, опубликованной в 1991 году, представили краткий обзор инструментальных методов, используемых при пресечении незаконного оборота наркотиков. Методы, используемые для обнаружения скрытых наркотиков, были разделены на два основных метода, основанных на массовом обнаружении и отборе проб воздуха. Методы объемного обнаружения включали рентгеновскую визуализацию, обратное гамма-рассеяние, активацию тепловых нейтронов и другие системы, в то время как методы отбора проб воздуха включали обнаружение паров ацетона, масс-спектрометрию, газовую спектрометрию и спектрометрию ионной подвижности. Авторы пришли к выводу, что все эти методы имеют ограничения и недостатки, и предложили необходимость более эффективных и избирательных методологий [110].
В недавнем отчете описан метод одновременного количественного определения Δ9-ТГК (1), каннабидиола (CBD) (35), каннабинола (CBN) (123) (рис. 24), когда он присутствует в C. sativa, с использованием последовательной хроматографии с силикагелем и ВЭЖХ в обратной фазе. Стадию колоночной хроматографии использовали для очистки растворимого в метаноле экстракта C. sativa [111].
Был опубликован метод ВЭЖХ-УФ с обратной фазой (обнаружение при 220 нм) для одновременного определения Δ9-ТГК (1), каннабидиола (CBD) (35) и каннабинола (CBN) (123) (рис. 24) в масле семян C. sativa [112]. Диапазон обнаружения был установлен на уровне 3,75–37,5 нг см−3, 0,125–1,25 нг см−3 и 0,735–7,35 нг см−3 для Δ9-ТГК, CBD и CBN соответственно. Эти средние показатели восстановления составили 96,1, 97,2 и 98,0% для Δ9-ТГК, CBD и CBN [112].
Де Баккера и соавт. разработана методика на основе ВЭЖХ/папа для идентификации, а также количественного определения Δ9-ТГК (1), Δ8-ТГК (16), ЦБС (21), КБР (35), к cbda (36), КНБ (123) (фиг. 24), THCA (125) (рис. 24), и cannabigerolic кислот (компонентов) (127) (рис. 24) в образцах наркотиков-тип, психотропных веществ, а волокна типа С. Sativa. Для установления оптимальных аналитических условий использовались прогностические полилинейные модели. Валидация этого метода была выполнена путем использования профилей точности, основанных на β-интервалы допусков математического ожидания для измерения общей погрешности и оценки неопределенностей измерений. Авторы утверждали, что этот метод полезен для идентификации фенотипов, оценки эффективности психоактивности и контроля качества C. sativa [41].
В недавно опубликованном исследовании, шагом и соавт. разработана нормально-фазовой высокоэффективной ТСХ-денситометрического метода определения и идентификации основных нейтральных каннабиноидов [Δ9-ТГК (1), ЦБС (21), ПГС (31), КБР (35), и THCV (124) (рис. 24)], а также одновременное определение Δ9-тетрагидроканнабинол и каннабинол (123) (фиг. 24) в двух лекарственных C. сатива сорта. Декарбоксилирование Δ9-ТГКА (125) (рис. 24) в растительном материале был получен путем нагрева при 100°C в течение 2 ч, перед анализом. Приборы CAMAG использовались для различных стадий хроматографии. Диапазон количественного определения был определен как 50-500 нг с использованием ультрафиолетового света при 206 нм для обнаружения. Результаты этого метода показали, что он сопоставим с проверенными методами ВЭЖХ, что делает его потенциально полезным для судебно-медицинского анализа и контроля качества конопли и лекарственного C. sativa [113].
Хазекамп и др. проведено исследование по хроматографическому и спектроскопическому анализу 16 основных каннабиноидов. В их аналитическом исследовании использовались показатели поглощения УФ, ИК, GC-MS и профилирование ВЭЖХ каннабиноидов, спектрофотометрический анализ и идентификация признаков флуоресценции этих каннабиноидов. Анализ GC-MS был проведен без предварительной дериватизации и привел к определению времени удерживания, молекулярных масс и спектров масс-спектрометрической фрагментации каннабиноидов [93].
Хемилюминесценция в последнее время используется для обнаружения каннабиноидов. Этот процесс основан на взаимодействии каннабиноидов с перманганатом калия в кислых условиях для получения эффекта хемилюминесценции. Этот метод в сочетании с ВЭЖХ использовался для определения каннабидиола (35). Авторы пришли к выводу, что этот метод может быть применен для анализа Δ9-ТГК (1) и других каннабиноидов в образцах C. sativa лекарственного класса [114].
Самый современный метод описал одновременное обнаружение и количественное определение 11 каннабиноидов, как в биомассе, так и в экстрактах различных сортов C. sativa, с использованием ВЭЖХ C 18 [115]. Каннабиноиды, которые были вовлечены в анализ включены Δ9-ТГК (1), Δ8-ТГК (16), ЦБС (21), ПГС (31), КБР (35), к cbda (36), cannabicyclol (КБР) (49), КНБ (123), THCV (124), THCA (125), и cbga (127). Разделение смеси каннабиноидов было достигнуто за 22,2 мин. Закономерности концентрации-реакции процесса демонстрировали линейные зависимости между концентрациями и областями пиков [115].